Тело медный купорос алюминий стеклянная пробирка: Конспект урока-зачета по теме «Первоначальные химические понятия», 8 класс — К уроку — Химия
«Первоначальные химические понятия» Дифференцированный зачет с использованием элементов игровых технологий Место урока – итоговый по данной теме. Тип урока – урок контроля и оценки знаний. Вид урока – игра, общественный смотр знаний. развивающие – развитие «учений учиться»: использовать ЗУН в учебной деятельности. воспитательные – осуществление самоконтроля и самооценки, побудить интерес к самостоятельному решению упражнений и задач, привить интерес к предмету, воспитание успеха. Требования к знаниям — Знать: Чистые вещества и смеси. Способы очистки веществ Физические и химические явления. Химические реакции. Признаки химических реакций и условия возникновения и течения химических реакций. Атомы и молекулы. Качественный и количественный состав вещества. Простые и сложные вещества. Химический элемент. Язык химии. Знаки химических элементов, химические формулы. Закон постоянства состава веществ. Атомная единица массы. Относительная атомная и молекулярная массы. Количество вещества, моль. Молярная масса. Валентность химических элементов. Определение валентности элементов по формулам их соединений. Составление химических формул по валентности. Атомно-молекулярное учение. Закон сохранения массы веществ. Химические уравнения. Классификация химических реакций по числу и составу исходных и полученных веществ. -Уметь: составлять формулы простых и сложных веществ, уравнения, определять типы реакций. Производить простейшие вычисления по формуле химического вещества. Методы и приемы: групповая работа, игровая технология, прием внешнего контроля знаний старшеклассниками, метод контроля и самоконтроля. План подготовки и проведения:
· — Валентная (формулы) 3. Подведение итогов. 4. Выставление оценок.
Подготовительный этап: 1. Перед изучением темы «Первоначальные химические понятия» учащимся объявляется информация о зачете и контрольных вопросах для самоподготовки. 2. На каждую «Станцию» назначается свой «Смотритель». Их задача — контроль действий учащихся на своём этапе. 3. Готовятся разноуровневые задания на карточках разных цветов, маршрутные листы (так, чтобы чередовались расчетные и теоретические станции, каждая из которых имеет свой цветовой сигнал). 2. Ход урока 1. Организационный момент. 2. Объявляется тема урока и организация проведения зачета: — Организуются 5 «станций» с указанием названия и цветовым сигналом.
3. Учитель объясняет правила проведения зачета:
Станция «Химическая»
Станция «Теоретическая» Выполнить тест: I Вариант: — Вещество: А) кислород; Б) вода; В) хлороводород; Г) поваренная соль. —Химическое явление: —Физическое явление: Станция «Расчетная» — относительную молекулярную массу, — массовую долю элемента в молекуле, — выводить формулу вещества по известным массовым долям элементов в соединении.
I вариант h3SО4
Станция «Практическая» (оценивается вся группа) Задания:
4. | |||||||||||||||||||||||||||||||||||||||||||||||||||
Определение плотности веществ — HintFox
Производство
-> Металлургия
| Автор: | Добавлено: 2015-03-23
В промышленности и сельском хозяйстве есть необходимость знать плотность используемых веществ, например, массу и объем бетона по его плотности рассчитывают бетонщики при заливке фундамента, колонн, стен, мостовых опор, откосов, плотин и т. д. Плотность вещества — это физическая величина, характеризующая массу тела, отнесенную к его объему.
При этом предполагается, что тело является сплошным, без пустот и примеси другого вещества. Данная величина для различных веществ отражена в справочных таблицах. Но интересно знать, каким образом заполняются такого рода таблицы, как определяют плотность неизвестных веществ. Самые простые способы определения плотности веществ:
Но интересно знать, каким образом заполняются такого рода таблицы, как определяют плотность неизвестных веществ. Самые простые способы определения плотности веществ:
• для жидкостей с помощью ареометра;
• Для жидкостей и твердых тел путем измерения объема и массы и вычисления по формуле.
Иногда по причине неправильной формы тел или их больших размеров бывает трудно или даже невозможно определить их объем с помощью линейки или мензурки. Тогда возникает вопрос, каким способом определить их плотность, не прибегая к измерению объема, или нет возможности определить массу вещества?
Цель работы: Решение экспериментальных задач по определению плотности различных веществ.
Задачи: 1) Изучить различные методы определения плотности вещества, описанные в литературе
2) Измерить плотность некоторых веществ методами, предложенными в литературе и оценить границы погрешностей каждого метода
3) Определить плотность неизвестного вещества на основе выявленных способов.
4)Представить в виде таблиц плотность растворов соли, сахара и
4 медного купороса различной концентрации.
Материалы и методика исследований: Исследования проводились с распространенными веществами: 10%-ый раствор соли, 10%-ый раствор медного купороса, вода, алюминий, сталь и т. д. Для измерений использовались приборы 4-го класса точности: весы с разновесами, ареометр, сообщающиеся сосуды от жидкостного манометра, а также набор калориметрических тел. Опыты проводились при комнатной температуре (20-250С), в помещении школы, в кабинете физики.
5
11. 3. Определение плотности жидкости а) Метод взвешивания тела в воздухе и неизвестной жидкости
Цель: Определить плотность жидкости (раствора медного купороса). Плотность ρ0 воды равна 1000 кг/м.
Приборы: Динамометр, нить, сосуд с водой, сосуд с неизвестной жидкостью, тело из набора калориметрических тел.
Ход работы: С помощью динамометра определяем вес тела в воздухе (P1), в воде (P2) и в неизвестной жидкости (P3).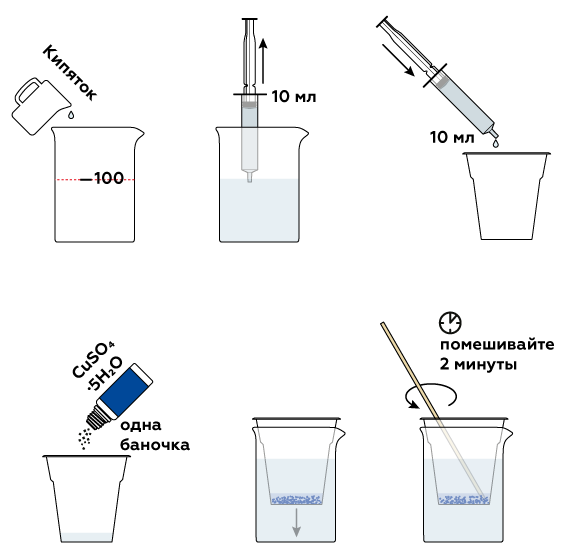
P2=0,7Н
Рз=0,6Н
FA=ρgV — сила
Архимеда Архимедова сила, действующая на тело в воде, равна
FA=P1-P2, а в неизвестной жидкости:
FA=P1-P3,
Согласно закону Архимеда запишем
P1-P2=ρ0Vg, (1)
P1-P3=ρVg. (2)
Решая систему уравнений (1) и (2), находим плотность неизвестной жидкости:
ρ=(P1-P3)/Vg, V=(P1-P2)/ρ0g, ρ=(P1-P3/P1-P2)ρ0.
ρ= (1H-0,6H/1H-0,7H)1000 кг/м3 = 400H кг/м3/0,3H=1333,(3) кг/м3 б) Метод сравнения с плотностью воды
Оборудование: Сообщающиеся сосуды из стеклянных трубок (со шкалой), резиновая трубка, мензурка, пипетка, колбы (или стеклянные банки) с различными жидкостями.
Ход работы: 1. На один конец сообщающихся сосудов надевают резиновую
6 трубку (предварительно зажав последнюю, чтобы через нее в сообщающиеся сосуды не вошел воздух).
2. Пипеткой наливают в сообщающиеся сосуды исследуемую жидкость (до определенного уровня).
3. Наливают (до некоторого уровня) дистиллированную воду в мензурку.
4. Свободный конец резиновой трубки погружают (до дна) в мензурку (рис. 1). При этом уровень жидкости в коленах сообщающихся сосудов изменится (пусть h2 — разность уровней в коленах)
5. Исследуемую жидкость из сообщающегося сосуда выливают и вместо нее наливают дистиллированную воду до прежнего уровня.
6. Вылив из мензурки воду, наливают в нее исследуемую жидкость до прежнего уровня.
7. Снова погружают свободный конец резиновой трубки в мензурку и опять находят разность уровней.
Поскольку высота уровня жидкости обратно пропорциональна ее плотности, можно записать: h2/h3 = ρx/ρв, или ρВ=h3ρВ/h2, где ρВ и ρX — соответственно плотности дистиллированной воды и исследуемой жидкости.
h2= 3,5 см h3= 5 см
ρX= 5 см / 3,5 см 1000кг/м3 = 1428 кг/м3
Таким образом, зная плотность жидкости, можно узнать, какую жидкость мы исследовали. В данном случае это медный купорос.
7
2. Определение плотности твердого тела а) Метод взвешивания образца в воздухе и воде
Оборудование: Весы с разновесом, стакан на 0,5 л, нитки и куски проволоки, исследуемые образцы (куски алюминия, олова, гранита, дерева, пластинка из плексигласа, корковая пробка).
Метод выполнения работы: Предлагаемый метод позволяет определить плотность любого вещества (имеющего плотность больше или меньше, чем у воды) с помощью взвешивания образца в воздухе и воде.
Пусть m1 — масса исследуемого тела. Тогда его вес в воздухе можно найти так:
Р =m1g, (1) где g — ускорение свободного падения. Погруженное в воду это тело имеет вес
P2=P1-FA, (2)
Здесь FA- архимедова сила:
FA= ρВV g (3)
(V — объем вытесненной телом воды, ρВ — ее плотность).
Уравновесив весы, получаем:
P2=m2g, (4) где та — масса гирь, которые необходимо поместить на левую чашку, чтобы уравновесить весы. Из (1) — (4) получаем: m2=m1-ρвV (5)
Поскольку объем V равен объему погруженного в воду тела, то можно записать:
V=m1/ρx (6) где ρx — плотность вещества, из которого состоит исследуемое тело. Из (5) и (6) находим:
ρx=m1/(m1-m2)ρв (7)
Порядок выполнения работы:
/. Плотность исследуемых тел больше плотности воды.
1. Определяют массу m1 исследуемого тела.
Определяют массу m1 исследуемого тела.
2. Привязывают исследуемое тело ниткой к левой чашке весов и опускают в стакан с водой (до полного погружения).
3. На эту же чашку помещают гири массой m2 необходимые для уравновешивания весов.
4. По формуле (7) определяют плотность ρx исследуемого тела. Результаты измерений заносят в таблицу 1.
Таблица 1
Вещество m1, 10-3 m2, 10-3 ρx, 103 ρy, 103 ε, %
кг кг кг м-3 кг м-3
Алюминий 21,85 13,65 2,664 2,698 1,2
Олово 62,4 53,85 7,2982 7,298 0,003
Гранит 17,35 10,75 2,628 2. 5-3 5
(камень)
Плексиглас 3,75 0,75 1,23 1,18 4,2
ΙΙ. Плотность исследуемых тел меньше плотности воды.
1. Измерить массу m1 исследуемого тела.
2. Тело жестко крепят к левой чашке весов с помощью трех кусков медной проволоки (диаметром 0,5 — 0,7 мм; два куска длиной 10 — 15 см, один -30 — 35 см). Для этого их концы скручивают в жгут, в котором укрепляют стальную иглу (или кусочек жесткой заостренной проволоки), а верхние концы коротких проволок крепят к выступам чашки весов (рис. 2).
2).
Уравновешивают весы. Затем накалывают исследуемое тело на иглу.
3. Тело полностью погружают в воду, а на левую чашку весов добавляют гири массой m2 и добиваются равновесия весов. По формуле
ρx=m1/(m1+m2)ρx находят плотность исследуемого тела. Результаты измерений заносят в таблицу 2.
Таблица 2
вещество m3,10-3 m2,10-3кг pх,103 кгм-3 ρy, табл. ε,%
кг кгм-3
Пробка Дерево 3,7 22,5 0,14 0,2 30
20 25 0,44 0,45 2,2 б) Метод, основанный на условиях плавания тел.
Оборудование: кусок пластилина, сосуд цилиндрической формы с водой
(ρ = 1 г/см3), линейка.
Ход работы: 1. Погружаем в сосуд с водой кусок пластилина и измеряем линейкой изменения уровня h2 жидкости в сосуде.
2. изготавливаем из пластилина «кораблик» и пускаем его плавать в сосуде с водой. Вновь измеряем изменение уровня h3 жидкости.
3. Находим плотность пластилина по формуле:
ρпласт =mпласт/Vпласт = ρSh3 / Sh2 = ρВh3/h2
ρпласт = ρВh3/h2 h2 = 2мм h3 = 4мм
ρпласт =1000 кг/м3 4мм / 2мм = 2000 кг/м3
Определение плотности неизвестного вещества
Цель: Определить плотность неизвестного вещества Х в твердом состоянии. Вещество Х не растворяется в воде и не вступает с ней в химические реакции.
Вещество Х не растворяется в воде и не вступает с ней в химические реакции.
Оборудование: Стеклянный стакан с водой, пробирка, линейка измерительная, неизвестное вещество Х в виде небольших кусков.
Ход работы: Сначала в пробирку поместим только неизвестное вещество Х и отметим глубину Н погружения пробирки. Затем удалим из пробирки вещество Х и нальем столько воды, чтобы глубина погружения Н во втором опыте была точно такой же, как в первом опыте. В этом случае масса воды mв в пробирке во втором опыте равна массе mх неизвестного вещества в первом опыте: mв= mX
Плотность ρX вещества Х можно вычислить, используя равенство ρX=mX/VX = mВ/VX для уменьшения возможных ошибок измерений при определении глубины Н погружения пробирки воспользуемся, следующим приемом.
Нальем в стакан столько воды, чтобы уровень ее был примерно на 1 см ниже края. Нагружая пробирку неизвестным веществом Х малыми порциями, добьемся такой глубины ее погружения, при котором верхний край пробирки находился на уровне верхнего края сосуда. Это положение пробирки можно определить с большой точностью с помощью линейки, положенной сверху стакана.
Это положение пробирки можно определить с большой точностью с помощью линейки, положенной сверху стакана.
Заменив затем неизвестное вещество водой, добьемся точно такой же глубины погружения пробирки, постепенно доливая в нее воду.
Измерим высоту h2 уровня воды в пробирке. Объем воды в пробирке равен
VВ= Sh2, где S — площадь внутреннего поперечного сечения пробирки. Опустим использованное ранее в опыте неизвестное вещество в пробирку с водой и измерим высоту уровня h3 воды в ней. Объем вещества Vх выразим через площадь S внутреннего поперечного сечения пробирки и изменение высоты уровня воды h3 — h2 в пробирке при опускании вещества в воду:
VX=(h3-h2)S.
Плотность вещества ρX равна
ρX = mX/VX = mВ/VX = ρВVВ/VX=ρВSh2/(S(h3-h2)),
ρX = ρВh2/(h3-h2).
h2 =3. 3 см h3= 3,8 см
ρX = 1000кг/м3
ρX =1000кг/м3 3,3 см/(3,8 см—3,3 см) = 3,3 см
1000 кг/м3 / 0,5 см = 6,6 см 1000 кг /м3 = 6600 кг/м3
Сравнивая с табличными данными наш результат, можно предположить, что неизвестное вещество — цинк.
Определение плотности жидкостей разной концентрации
Цель: Определить плотности растворов соли, сахара и медного купороса разной концентрации. На основе полученных данных составить таблицы. Оборудование: Весы с разновесами, пробирка (250 мл), алюминиевый стаканчик.
Вещества: Сахар, соль, медный купорос. Ход работы: а) Соляной раствор
Для того чтобы получить раствор с разной концентрацией, нужно добавлять по одной чайной ложке (5,6г) соли в воду. После каждой ложки нужно измерить вес и объем получившегося раствора, учитывая, что m стакана= 44,75г.
Какова химическая формула медного купороса и его применение?
Какова химическая формула медного купороса? Медный купорос, или сульфат меди, представляет собой синий кристаллический порошок, обычно продаваемый как химический реагент в твердой форме. Это гидратированный пентагидрат сульфата меди, химическая формула которого: CuSO 4 .5H 2 O. Медный купорос представляет собой растворимый в воде кристалл. В природе встречается в виде рыхлых микрокристаллов серого или черного цвета. Он нестабилен и быстро разлагается при комнатной температуре.
В природе встречается в виде рыхлых микрокристаллов серого или черного цвета. Он нестабилен и быстро разлагается при комнатной температуре.
Как действует медный купорос?
Медный купорос, обычно в твердой форме, вступает в почти немедленную реакцию при контакте с некоторыми веществами (например, жидкостью для снятия лака с ногтей). Порошок синего купороса вступает в реакцию с химическими веществами, присутствующими в жидкости для снятия лака, в результате чего образуется синий раствор сульфата меди и воды. Химическая формула реакции: CuSO 4 + уксусная кислота + этилацетат → CuSO 4 .5H 2 O + 2этилацетат + уксусная кислота
Применение медного купороса
1. В качестве противогрибкового средства
Медный купорос в основном используется в качестве противогрибкового средства при лечении различных кожных и инфекционных заболеваний. Он используется в качестве противогрибкового средства против грибковых инфекций. Его можно использовать для контроля, профилактики и лечения грибковых инфекций, а также для уничтожения грибков (дрожжей и т. д.).
д.).
2. В качестве чистящего средства
Медный купорос используется в домашнем хозяйстве в качестве чистящего средства для различных работ по очистке, таких как стеклянная посуда и т. д. Медный купорос также используется в готовых моющих средствах или отбеливателях из-за его высокой рН и его способность споласкиваться водой без остатка на банках, бутылках или стаканах после мытья.
3. Для мытья окон и стеклянной посуды
Отличное чистящее средство для удаления жира со стекол автомобиля, стеклянной посуды и других предметов домашнего обихода. Он также используется для удаления жирного материала, оставшегося на непористой воде, например, на поверхности душевых кабин и умывальников.
4. Для изготовления красок, красок от разбавителей до лаков, красок для чернил, глазури и т. д.
Еще одно применение медного купороса — для изготовления красок (от разбавителей до лаков) и красок для чернил с использованием его в качестве восстановителя. Его также можно использовать для глазури и лакировки в керамических изделиях, таких как производство фарфора и т. д.
д.
5. В качестве красителя
Медный купорос также используется в качестве красителя, который в основном используется в текстильной промышленности для придания ткани синего цвета. Его также можно использовать для производства некоторых красителей для шерсти и шелка.
6. В качестве абсорбента, осушителя, регулятора pH и т. д.
Медный купорос также может использоваться сам по себе в качестве абсорбента для удаления избыточной воды, оставшейся на определенных предметах, таких как стеклянная посуда или другие предметы домашнего обихода. Он также используется в качестве осушителя и регулятора pH в процессе виноделия.
7. Как загрязнитель окружающей среды
Какова химическая формула медного купороса? Медный купорос может быть токсичным для водной среды, особенно при попадании в реки и другие водоемы. Это также может нарушить водную жизнь. Это может вызвать гибель рыб, обширный рост водорослей, изменение цвета воды и т. д. Этот эффект вызван чрезмерным выделением сульфата меди в результате промышленной деятельности, такой как очистка сточных вод и т. д.
д.
8. Для использования в нетрадиционной медицине
Медный купорос используется в качестве альтернативного средства для различных альтернативных медицинских и медицинских процедур. Он в основном используется в качестве пигмента, который используется в красках и красках от разбавителей до лаков. Его также можно использовать для изготовления красителей и чернил, а также для окрашивания или окрашивания. Сухой порошок медного купороса можно измельчить и принимать в качестве пищевой добавки. Порошок также можно наносить на определенные части тела, например, на пораженный участок кожи и т. д. Этот порошок вызывает ощущение жжения на участке кожи, на который он наносится, и помогает уменьшить воспаление и боль.
9. Для использования в горнодобывающей промышленности
Медный купорос используется в качестве минеральной руды в горнодобывающей промышленности. Он используется для производства сульфата меди электролизом или путем изменения кислотности воды и добавления к ней электричества. В результате химической реакции высвобождается газообразный водород и в то же время выделяется кислород. В ходе этой реакции образуется смесь меди высокой чистоты и серной кислоты, которую можно использовать для получения серной кислоты.
В результате химической реакции высвобождается газообразный водород и в то же время выделяется кислород. В ходе этой реакции образуется смесь меди высокой чистоты и серной кислоты, которую можно использовать для получения серной кислоты.
Заключение
Какова химическая формула медного купороса? Медный купорос — это широко используемое химическое соединение, которое можно найти в бытовых чистящих средствах, которое служит различным целям. Он также широко используется для производства других химических веществ.
Отказ от ответственности: ECHEMI оставляет за собой право окончательного объяснения и пересмотра всей информации.
Сульфат меди, медный купорос — (500 г)
| Наличие: | В наличии | |
| Количество: | х 1 кс | |
| Цена с НДС: | 3,67 € ( 3,06 € без НДС) | |
ДОБАВИТЬ В КОРЗИНУ | ||
Наименование
Пентагидрат сульфата меди, сульфат меди (II), сульфат меди, медный купорос (пентагидрат), медный купорос (пентагидрат)
Информация
Сульфат меди (CuSO4), известный под тривиальным названием медный купорос, ранее как медный купорос, является наиболее распространенным соединением меди. Безводный представляет собой белый порошок, который потребляет голубую воду. Поэтому используется для демонстрации воды в органических жидкостях или в качестве влагопоглотителей.
Безводный представляет собой белый порошок, который потребляет голубую воду. Поэтому используется для демонстрации воды в органических жидкостях или в качестве влагопоглотителей.
Водный раствор кристаллизуется в виде пентагидрата (медного купороса) CuSO4 · 5h3O в темно-синие прозрачные триклинные кристаллы, которые вьются на поверхности воздуха. Медный купорос технически является наиболее важной солью меди.
Эксплуатация
Материал для производства минеральных красок
Пропитка древесины против гнили
Консервирование фаршированное
Протравка семян
Бордоска йича (смесь раствора медного купороса и известкового молока) — средство борьбы с вредителями овощных культур
Борьба с водорослями в бассейнах
Удаление мха с крыш
Часть poměďovacích spa
Окрашивание кожи
Вяжущее и протравочное средство в медицине
Интересно: Как создать кристаллический сульфат меди — инструкция
1-й Приготовьте насыщенный раствор сульфата меди:
Нагрейте воду примерно до 50 градусов Цельсия и растворите в ней сульфат меди до тех пор, пока он не перестанет растворяться (температура поддерживается на уровне 50 градусов Цельсия).
2-й Когда раствор перестанет растворяться, перелейте раствор в другую емкость и дайте ему самопроизвольно остыть (чем дольше раствор будет остывать, тем лучше). При охлаждении начинают формироваться кристаллы. После того, как раствор остынет до комнатной температуры, оставьте помещение на несколько дней. Раствор испарит воду, и кристаллы продолжат расти.
3-й Если образовавшиеся кристаллы слишком малы, повторите процедуру, но начальную температуру, при которой растворяется Skalica, уменьшите до 30, максимум до 40 градусов Цельсия. Может быть, даже меньше — тогда больше времени займет рост кристаллов испарением. Для роста кристаллов необходимо время пересыщения раствора. (Пересыщенный раствор возникает в первой и второй части охлаждения путем испарения. При охлаждении и там раствор насыщается и начинают выпадать кристаллы, затем раствор насыщается дальнейшим испарением.)
Самые крупные кристаллы растут на стадии испарения. Чем дольше стадия испарения, тем лучше для размера кристалла.
Если выбрать высокую начальную температуру насыщения, происходит быстрое охлаждение, перегрузка и, как следствие, большое количество мелких кристаллов. Если это произошло, необходимо снизить начальную температуру (см. выше).
Наш совет: интересные формы можно получить, если поместить в раствор камень или другой небольшой предмет, с которого вы хотите собрать кристаллы, или погрузив его в веревку, привязанную к карандашу, который вы наденете на верхний край стакана. .
Технические характеристики
Формула: CuSO4. 5h3O
CAS: 7758-99-8
EC: 231-847-6
Предел ADR (кг, л): 1000
UN: UN3077
Срок годности (мес): 24
Внешний вид: Синие кристаллы
Без запаха
Температура плавления/замерзания (°С): выше 110°С теряет кристаллизационную воду, выше 650°С. разл.
ТЕМПЕРАТУРА ВСПЫШКИ: не воспламеняется
Относительная плотность: 2,280
Растворимость в воде: 1000 г/л
Коп: мин. 23,5%
23,5%
Fe: макс. 0,2%
Страна происхождения
Румыния
Токсикологические данные
Сульфат меди является токсичным веществом, при проглатывании возникает сильная рвота с кровью. Жертва может умереть в течение 7 часов. Проглатывание больших количеств еще раньше. В качестве противоядия дайте пострадавшему молоко и немедленно вызовите рвоту.
Хранение
Хранить плотно закрытым в оригинальной упаковке.
Сигнальное слово: Осторожно
h402 — Вреден при проглатывании.
h419 — Вызывает серьезное раздражение глаз.
h415 — Вызывает раздражение кожи.
h510 — Очень токсичен для водных организмов с долгосрочными последствиями.
P273 — Избегайте попадания в окружающую среду.
P280 — Надевайте защитные перчатки/защитную одежду/средства защиты глаз/лица.
P301+P312 — ПРИ ПРОГЛАТЫВАНИИ: Позвоните в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР/к врачу/…/, если вы плохо себя чувствуете.


 Назначаются консультанты из числа старшеклассников (с ними разбираются основные вопросы, проводится инструктаж по технике безопасности при проведении опытов).
Назначаются консультанты из числа старшеклассников (с ними разбираются основные вопросы, проводится инструктаж по технике безопасности при проведении опытов). .
. Каждая группа получает маршрутные лист с указанием фамилий участников группы и названием «станции»:
Каждая группа получает маршрутные лист с указанием фамилий участников группы и названием «станции»:
 Определить валентность элементов в следующих формулах:
Определить валентность элементов в следующих формулах:
 Подведение итогов. Выставление оценок.
Подведение итогов. Выставление оценок.