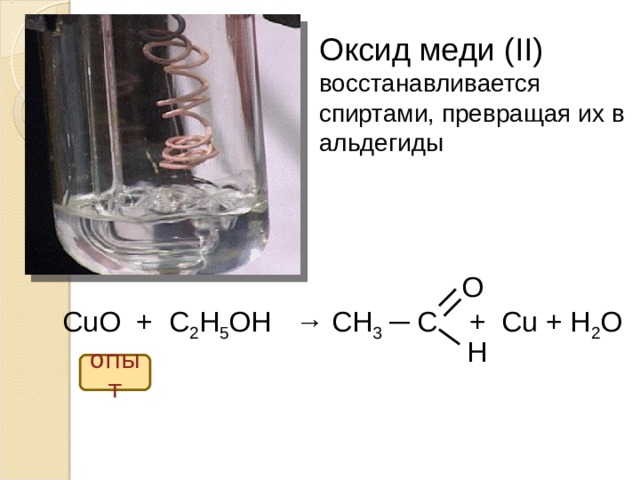
Уксус оксид меди: Запишите уравнение реакций взаимодействия уксусной кислоты с цинком и оксидом меди (II)
Содержание
польза и вред. Как ухаживать за медной посудой.
Медная посуда: польза и вред. Как ухаживать за медной посудой. Многие кулинары-любители мечтают раскрыть секреты знаменитых поваров. Но бывает, что необыкновенный вкус приготовленного блюда зависит не столько от правильно подобранных составляющих и всевозможных специй, сколько от полезных качеств используемой посуды. На кухне дорогого ресторана, где работают профессионалы, и у опытной хозяйки всегда найдется медная посуда. Польза и вред, оказываемые ею на здоровье человека, обязательно должны учитываться перед приобретением этих предметов кухонной утвари. Достоинства медной посуды Наиболее важной характеристикой медной посуды следует считать ее высокую теплопроводность, которая в 10 раз выше, чем у стальной или алюминиевой емкости. Это способствует равномерному распределению тепла по всей поверхности, что значительно ускоряет процесс приготовления пищи, не снижая ее вкусовые качества. Считается, что особенно вкусное варенье или пикантный соус получаются, если готовятся именно в медной посуде. За счет снижения времени на термическую обработку пищи ее полезные вещества сохраняются. Легкий вес и долговечность также являются неоспоримыми достоинствами, которыми обладает медная посуда. Польза и вред, которые может принести медь здоровью человека, заслуживают отдельного внимания. Полезные свойства медной посуды На протяжении многих веков используется людьми медная посуда. Свойства, недостатки, и как ухаживать за кастрюлями и сковородками, выполненными из меди, — все это известно с давних пор. Одним из самых главных полезных свойств медной посуды следует назвать ее антибактериальное действие. Медь способна бороться с целым рядом грибков и бактерий, не допуская их попадания в пищу. В старину в медных емкостях хранили воду с целью ее обеззараживания. Американские ученые экспериментальным путем доказали, что медь успешно справляется со штаммами сальмонеллы, а также кишечной палочки. Пища, которая готовится в медной посуде, обеззараживается, предотвращая появление заболеваний желудочно-кишечного тракта.
За счет снижения времени на термическую обработку пищи ее полезные вещества сохраняются. Легкий вес и долговечность также являются неоспоримыми достоинствами, которыми обладает медная посуда. Польза и вред, которые может принести медь здоровью человека, заслуживают отдельного внимания. Полезные свойства медной посуды На протяжении многих веков используется людьми медная посуда. Свойства, недостатки, и как ухаживать за кастрюлями и сковородками, выполненными из меди, — все это известно с давних пор. Одним из самых главных полезных свойств медной посуды следует назвать ее антибактериальное действие. Медь способна бороться с целым рядом грибков и бактерий, не допуская их попадания в пищу. В старину в медных емкостях хранили воду с целью ее обеззараживания. Американские ученые экспериментальным путем доказали, что медь успешно справляется со штаммами сальмонеллы, а также кишечной палочки. Пища, которая готовится в медной посуде, обеззараживается, предотвращая появление заболеваний желудочно-кишечного тракта.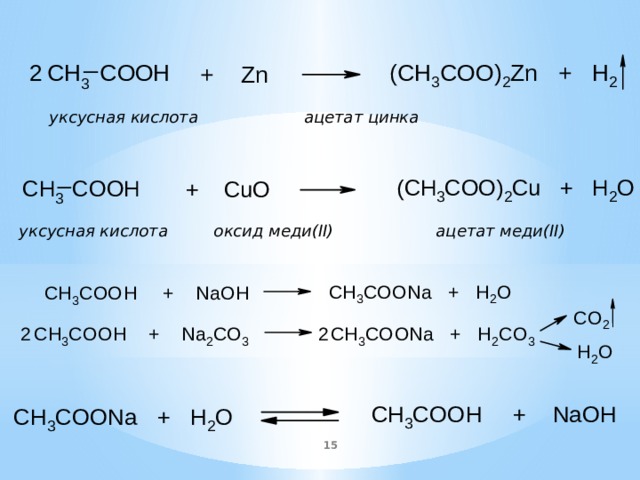 Недаром издавна медь применялась в народной медицине для лечения многих заболеваний: при интоксикации организма, судорогах, язвах, геморрое и т. д. Вред медной посуды Кроме положительных свойств, которыми обладает медь, ученые обнаружили и ряд отрицательных факторов, которые могут нанести вред здоровью или негативно повлиять на качество приготовляемых в такой посуде продуктов: Аскорбиновая кислота, которая содержится во фруктах и ягодах, под агрессивным воздействием меди разрушается. При хранении продуктов в медной посуде происходит потеря витаминов и окисление полиненасыщенных жирных кислот, что может способствовать возникновению онкозаболеваний. Вред посуды особенно серьезен, если она находится во влажной среде. Повышенная влажность вызывает окисление меди, это проявляется в виде зеленого налета. При взаимодействии с пищевыми кислотами во время нагревания вырабатываются особо вредные для организма вещества. Поэтому при появлении на посуде такого налета необходимо его тщательно удалить, протерев поверхность поваренной солью, смоченной в уксусе.
Недаром издавна медь применялась в народной медицине для лечения многих заболеваний: при интоксикации организма, судорогах, язвах, геморрое и т. д. Вред медной посуды Кроме положительных свойств, которыми обладает медь, ученые обнаружили и ряд отрицательных факторов, которые могут нанести вред здоровью или негативно повлиять на качество приготовляемых в такой посуде продуктов: Аскорбиновая кислота, которая содержится во фруктах и ягодах, под агрессивным воздействием меди разрушается. При хранении продуктов в медной посуде происходит потеря витаминов и окисление полиненасыщенных жирных кислот, что может способствовать возникновению онкозаболеваний. Вред посуды особенно серьезен, если она находится во влажной среде. Повышенная влажность вызывает окисление меди, это проявляется в виде зеленого налета. При взаимодействии с пищевыми кислотами во время нагревания вырабатываются особо вредные для организма вещества. Поэтому при появлении на посуде такого налета необходимо его тщательно удалить, протерев поверхность поваренной солью, смоченной в уксусе. Покрытие медной посуды С продуктами, обладающими повышенной кислотностью, медная посуда взаимодействует отрицательно. Для того чтобы предотвратить окисление и сделать приготовление пищи безопасным, изнутри медную емкость покрывают обычно специальными сплавами олова, железа или никеля. Когда такое покрытие протирается — посуду следует менять. При приготовлении пищи в медной посуде лучше всего пользоваться деревянной лопаточкой, чтобы не поцарапать внутреннюю поверхность. Уход за посудой из меди Медная посуда нуждается в более бережном уходе по сравнению с какой-либо другой. Ее необходимо периодически тщательно полировать, чтобы избежать налета, соблюдать условия хранения — такая посуда не терпит высокой влажности. Это для меди враг номер один. Не рекомендуется мыть медные предметы в посудомоечной машине, т. к. использование при этом сильных моющих средств может повредить их, значительно сократив срок службы. По этой же причине не стоит применять для чистки моющие средства, содержащие отбеливатель.
Покрытие медной посуды С продуктами, обладающими повышенной кислотностью, медная посуда взаимодействует отрицательно. Для того чтобы предотвратить окисление и сделать приготовление пищи безопасным, изнутри медную емкость покрывают обычно специальными сплавами олова, железа или никеля. Когда такое покрытие протирается — посуду следует менять. При приготовлении пищи в медной посуде лучше всего пользоваться деревянной лопаточкой, чтобы не поцарапать внутреннюю поверхность. Уход за посудой из меди Медная посуда нуждается в более бережном уходе по сравнению с какой-либо другой. Ее необходимо периодически тщательно полировать, чтобы избежать налета, соблюдать условия хранения — такая посуда не терпит высокой влажности. Это для меди враг номер один. Не рекомендуется мыть медные предметы в посудомоечной машине, т. к. использование при этом сильных моющих средств может повредить их, значительно сократив срок службы. По этой же причине не стоит применять для чистки моющие средства, содержащие отбеливатель.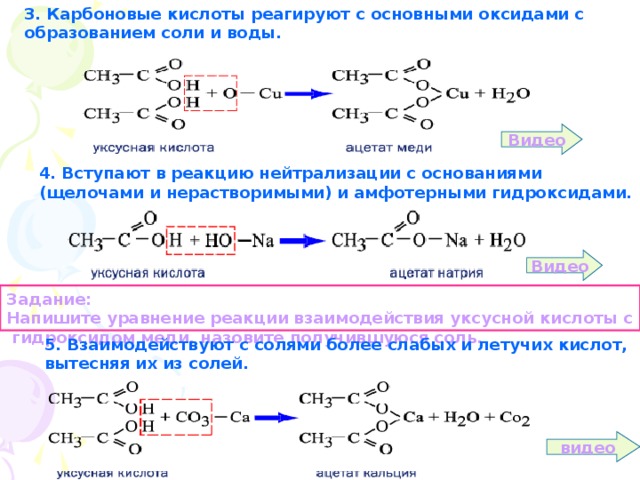 Для мытья нужно использовать мягкую тряпочку или губку без абразивного слоя, чтобы не повредить защитный слой на внутренней поверхности.
Для мытья нужно использовать мягкую тряпочку или губку без абразивного слоя, чтобы не повредить защитный слой на внутренней поверхности.
Уксусная кислота, химические свойства, производство, применение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Почему монеты выглядели грязными до того, как я положил их в уксус? Все вокруг вас состоит из крошечных частиц, называемых атомами. Некоторый Почему уксус и соль очистили пенни? Оксид меди растворяется в смеси слабой кислоты и поваренной соли и уксуса Почему немытые монетки стали сине-зелеными? Когда уксус и соль растворяют слой оксида меди, они Как гвоздь и шуруп покрылись медью? Чтобы понять, как гвоздь и шуруп покрылись медью, нужно Когда Теперь добавьте в смесь два стальных гвоздя и шуруп. Сталь это металл Первоначально стальной гвоздь был заряжен нейтрально, но когда ионы железа Почему со стального винта пошли пузыри? Каждая молекула воды состоит из двух атомов водорода и атома кислорода. |
Бытовая химия — Что является продуктом реакции меди и уксуса?
На самом деле, реакция уксуса на металлическую медь практически отсутствует (следовательно, медная проволока в растворе чистая). Существующее покрытие $\ce{Cu2O}$ будет медленно разрушаться, образуя ацетат меди, который в воздухе/кислороде образует растворимый ацетат меди. Последний служит слабым электролитом для дальнейшего электрохимического воздействия на металлическую медь $\ce{O2}$ с задержкой начала периода.
Пропускание воздуха в раствор или, что более эффективно, добавление $\ce{h3O2}$ способствует протеканию электрохимической реакции, как и добавление небольшого количества хорошего электролита (например, $\ce{NaCl}$, который также образует комплексы с нерастворимыми медь, образующая растворимое соединение меди). {[3] }}$ (оба источника отмечают электрохимические аспекты реакции).
{[3] }}$ (оба источника отмечают электрохимические аспекты реакции).
Теперь, почему черное покрытие $\ce{CuO}$ (и основной ацетат меди) на части медной проволоки, подверженной воздействию воздуха, паров кислоты, паров воды и частиц пыли? Поскольку, исходя из приведенной выше реакции, я предполагаю, что $\ce{CuO}$ и основной ацетат меди будут ожидаемыми продуктами в условиях низкого содержания воды в присутствии кислорода/воздуха и H+. Я бы еще предположил, что пыль может быть источником электролита или других металлов, таких как железо. Это может привести к так называемой окислительно-восстановительной паре, способствующей рециркуляции ионов меди в соответствии с реакцией: 9+}$$
Теперь любой, кто нагревал металлическую медь в пламени, знает, что даже при высоких температурах $\ce{Cu/Cu2O}$ НЕ легко реагирует с кислородом воздуха с образованием черного $\ ce{CuO}$ (и использование метанового пламени проблематично, так как $\ce{Ch5}$ может восстановить любой образовавшийся $\ce{CuO}$ обратно в $\ce{Cu}$, поэтому явно плохой путь к оксиду меди ).
Многие, скорее всего, знакомы с упомянутой выше ключевой электрохимической реакцией в случае с металлическим железом, процессом, описанным как образование РЖАВЧИНЫ. Интересно, что железо не легко разлагается холодными минеральными кислотами, а окисляющими кислотами, такими как $\ce{HNO3}$ и даже слабым $\ce{HOCl}$ (хлорноватистая кислота). Добавление кислорода и даже слабой $\ce{h3CO3}$ (угольной кислоты) в присутствии $\ce{NaCl}$ будет электрохимически атаковать металлическое железо (и, что медленнее, металлическую медь). 9{[5]}}$ .
Ссылки
- https://en.wikipedia.org/wiki/Dicopper_chloride_trihydrooxide
- https://www.researchgate.net/publication/259637387_Ammonia_Leaching_A_New_Approach_of_Copper_Industry_in_Hydrometallurgical_Processes
- «Кинетика и механизм растворения меди в водном аммиаке», https://www.academia.edu/292096/Kinetics_and_Mechanism_of_Copper_Dissolution_In_Aqueous_Ammonia
- https://www.sciencemadness.

.

 Как вы узнали, когда
Как вы узнали, когда