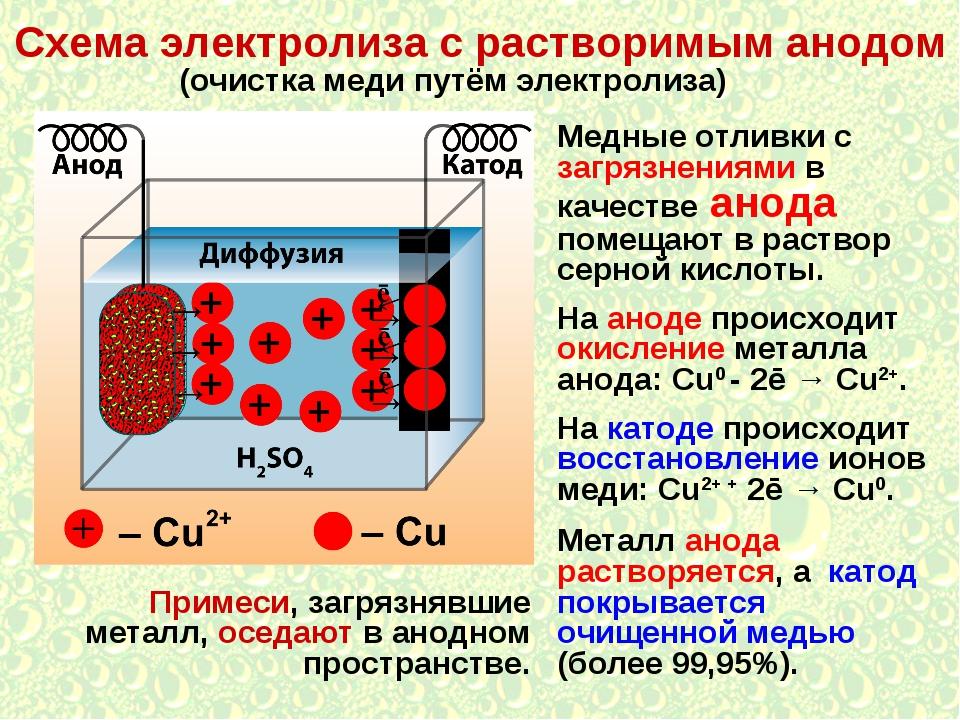
Заряд никеля: ICSC 0062 — НИКЕЛЬ
Содержание
Свинцово-кислотные и никель-кадмиевые аккумуляторные батареи для запуска двигателей генераторов
Зарядное устройство заставляет электроны отделяться от катода, оставляя его с чистым положительным зарядом, и направляет эти электроны на анод, придавая ему отрицательный заряд. Энергия, закачиваемая в ячейку, переводит активные химические вещества обратно в их исходное состояние.
В производстве генераторных установок в основном используются зарядные устройства автоматического типа для резервных приложений.
Разработчик системы выбирает тип батареи исходя из ее достоинств для конкретного приложения. В этой статье описывается принцип действия и изготовления двух типов батарей, а также их различные преимущества и недостатки.
Свинцово-кислотные батареи
Эти батареи вырабатывают напряжение в результате реакции свинца и оксида свинца с влажным элементом с разбавленным сернокислым электролитом. Когда нагрузка подключается к отрицательному и положительному электродам, отрицательный свинцовый электрод реагирует с сульфатом в электролите с образованием сульфата свинца. Отрицательный свинцовый электрод подает положительные ионы и остается отрицательным. Когда на электроды подается заряд, происходит обратная реакция с энергией зарядного устройства, сульфат свинца расщепляется кислородом из ионизированной воды. Оксид свинца осаждается на положительном электроде, а свинец — на отрицательном электроде.
Отрицательный свинцовый электрод подает положительные ионы и остается отрицательным. Когда на электроды подается заряд, происходит обратная реакция с энергией зарядного устройства, сульфат свинца расщепляется кислородом из ионизированной воды. Оксид свинца осаждается на положительном электроде, а свинец — на отрицательном электроде.
Преимущества свинцово-кислотных аккумуляторов
Свинцово-кислотные аккумуляторы являются наиболее широко используемыми аккумуляторами для запуска двигателей из-за того, что они доминируют в автомобильной промышленности. Первоначальная стоимость покупки невысока, но затраты на жизненный цикл могут быть выше в зависимости от приложения (см. Сравнительную таблицу выше). К другим преимуществам относятся его способность обеспечивать высокий ток, возможность оставаться на постоянном / постоянном заряде в течение длительного периода времени и его универсальная доступность во многих вариантах.
Недостатки свинцово-кислотной системы
Они не подходят для быстрой зарядки.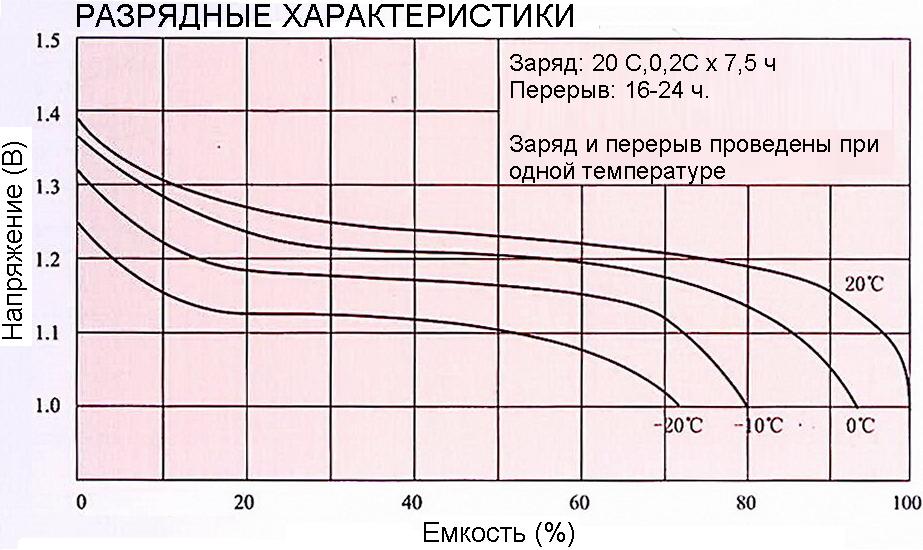 У них более низкий срок службы, чем у никель-кадмиевых, более низкий температурный предел и они требуют большего обслуживания из-за выделения газов.
У них более низкий срок службы, чем у никель-кадмиевых, более низкий температурный предел и они требуют большего обслуживания из-за выделения газов.
Никель-кадмиевые аккумуляторы
Никель-кадмиевые батареи, используемые для выработки электроэнергии, также относятся к типу влажных элементов, но электролит представляет собой гидроксид калия (щелочной). Положительный электрод представляет собой гидроксид никеля Ni (OH), а отрицательный электрод — кадмий (Cd). Электролит гидроксида калия не принимает участия в реакциях заряда-разряда и действует только как носитель заряда. На отрицательном электроде (катоде) кадмий окисляется до гидроксида кадмия при разряде, в то время как гидратированные соединения никеля на положительном электроде (аноде) восстанавливаются до гидроксида никеля.
Никель-кадмиевые батареи для промышленного использования бывают вентилируемого (открытого) или полугерметичного типа и могут иметь конструкцию карманного типа, спеченную пластину или волокнистую структуру.
Преимущества никель-кадмиевой технологии
NiCd часто выбирают для телефонных систем и резервных генераторов из-за его способности работать в широком диапазоне температур, его более длительного срока службы при перезарядке в 3-5 раз больше, чем у свинцово-кислотного, меньшего количества требований к техническому обслуживанию (дозаправка не требуется. требуется в течение многих лет) и более высокая скорость зарядки и разрядки.
Недостатки никель-кадмия
Никель-кадмиевые батареи изначально стоят больше, чем свинцово-кислотные, включают кадмий, потенциально опасный материал, и имеют более высокую скорость саморазряда (что в больших аккумуляторных системах может привести к более высоким затратам на энергию плавающего заряда).
КОМПОЗИТЫ НА ОСНОВЕ ВОССТАНОВЛЕННОГО ОКСИДА ГРАФЕНА И ГИДРОКСИДА НИКЕЛЯ КАК ПЕРСПЕКТИВНЫЕ МАТЕРИАЛЫ ДЛЯ ГИБРИДНЫХ СУПЕРКОНДЕНСАТОРОВ | Баскаков
1. Полякова А.Л., Васильев, Б.М., Купенко И.Н. и др. Изменение зонной структуры полупроводников под давлением // Физика и техникаполупроводников. 1976. Т. 9, № 11. С. 2356-2358.
1976. Т. 9, № 11. С. 2356-2358.
2. C. Liu, F. Li, L.P. Ma, H.M. Cheng, Advanced materials for energy storage // Adv. Mater. 2010. 22, Ε1-Ε35.
3. Y. Zhang, H. Feng, X.B. Wu, L.Z. Wang, A.Q. Zhang, T.C. Xia, H.C. Dong, X.F. Li, L.S. Zhang, Progress of electrochemical capacitor electrode materials: a review // Int. J. Hydrogen Energy. 2009. 34, р. 4889-4899
4. H.Q. Cao, H. Zheng, K.Y. Liu, J.H. Warner, Bioinspired peony-like ß-Ni(OH)2 nanostructures with enhanced electrochemical activity and superhydrophobicity // ChemPhysChem. 2010. 11, р. 489-494.
5. G. Duan, W. Cai, Y. Luo, F. Sun, A hierarchically structured Ni(OH)2 monolayer hollow-sphere array and its tunable optical properties over a large region // Adv. Funct. Mater. 2007. 17 р. 644-650.
6. Y.Y. Luo, G.H. Li, G.T. Duan, L.D. Zhang, One-step synthesis of spherical a-Ni(OH)2 nanoarchitectures // Nanotechnology. 2006. 17, р. 4278-4283.
7. D. Linden, Handbook of Batteries, McGraw-Hill, New York, 2002.
8. J. McBreen, Modern Aspects of Electrochemistry, vol. 21, Plenum, New York,1990.
9. M.S. Wu, C.M. Huang, Y.Y. Wang, C.C. Wan, Effects of surface modification of nickel hydroxide powder on the electrode performance of nickel/metal hydride batteries // Electrochim. Acta. 1999. 44(23), p.4007-4016.
10. Shul’ga Yu.M., Lobach A.S., Baskakov S.A. et al. A comparative study of graphene materials formed by thermal exfoliation of graphite oxide and chlorine trifluoride-intercalated graphite // High Energy Chem. 2013. 47(6), p 331-338
11. С.А. Баскаков, Ю.М. Шульга, Ю.В. Баскакова, А. Д. Золотаренко, И.Е. Кузнецов, О.Н. Ефимов, А. Л. Гусев. Новые композитные материалы на основе восстановленного оксида графена и полианилина для электродов суперконденсаторов высокой емкости // Альтернативная энергетика и экология. 2012. 12(116), с. 66-76
12. В.Е. Мурадян, М.Г. Езерницкая, В.И. Смирнова, Н.М. Кабаева и др. Превращение окиси графита в условиях ионного гидрирования. // ЖОХ. 1991. Т.61, Вып.12, с.2626-2629
1991. Т.61, Вып.12, с.2626-2629
13. Si Y., Samulski E.T. Synthesis of water soluble grapheme // Nano Lett. 2008. V 8. P. 1679-1682.
14. Jeong H.-K., Lee Y.P., Jin M.H. et al. Thermal stability of graphite oxide // Chem. Phys. Lett. 2009. 470, р. 255-258.
15. Cote L.J., Cruz-Silva R., Huang J. Flash Reduction and Patterning of Graphite Oxide and Its Polymer Composite // J. Am. Chem. Soc. 2009. V. 131. P. 1102711032.
16. Lin Yang, Jianguo Zhu, Dingquan Xiao. Microemulsion-mediated hydrothermal synthesis of ZnSe and Fe-doped ZnSe quantum dots with different luminescence characteristics // RSC Adv. 2012. 2, p.8179-8188
17. F.S. Cai, G.Y. Zhang, J. Chen, X.L. Gou, H.K. Liu, S.X. Dou. Ni(OH)2Tubes with Mesoscale Dimensions as Positive-Electrode Materials of Alkaline Rechargeable Batteries// Angew. Chem. Int. Ed. 2004. 43(32), р.4212-4216. a review // Int. J. Hydrogen Energy. 2009. 34, r. 48894899.
18. D.A. Corrigan, R.M. Bendert, Effect of Coprecipitated Metal Ions on the Electrochemistry of Nickel Hydroxide Thin Films: Cyclic Voltammetry in 1М KOH// J. Electrochem. Soc. 1989. 136(3), р.723-728
Electrochem. Soc. 1989. 136(3), р.723-728
никель | Определение, свойства, символы, использование и факты
никель
Посмотреть все СМИ
- Ключевые люди:
- Аксель Фредрик Кронстедт
Поль Сабатье
Шарль Эдуард Гийом
- Похожие темы:
- химический элемент
переходный металл
обработка никеля
нейзильбер
никель Ренея
См. все связанные материалы →
никель (Ni) , химический элемент, ферромагнитный металл группы 10 (VIIIb) периодической таблицы Менделеева, заметно устойчивый к окислению и коррозии.
| атомный номер | 28 |
|---|---|
| атомный вес | 58,69 |
| температура плавления | 1453 °C (2647 °F) |
| температура кипения | 2732 ° С (4,950 °F) |
| плотность | 8,902 (25 °C) |
| степени окисления | 0, +1, +2, +3 |
| электронная конфигурация | [Ar]3 d 8 4 s 2 |
Свойства, возникновение и использование
Серебристо-белый, прочный и более твердый, чем железо, никель широко известен из-за его использования в чеканке монет, но более важен как чистый металл, так и в виде сплавов для многих бытовых и промышленных применений.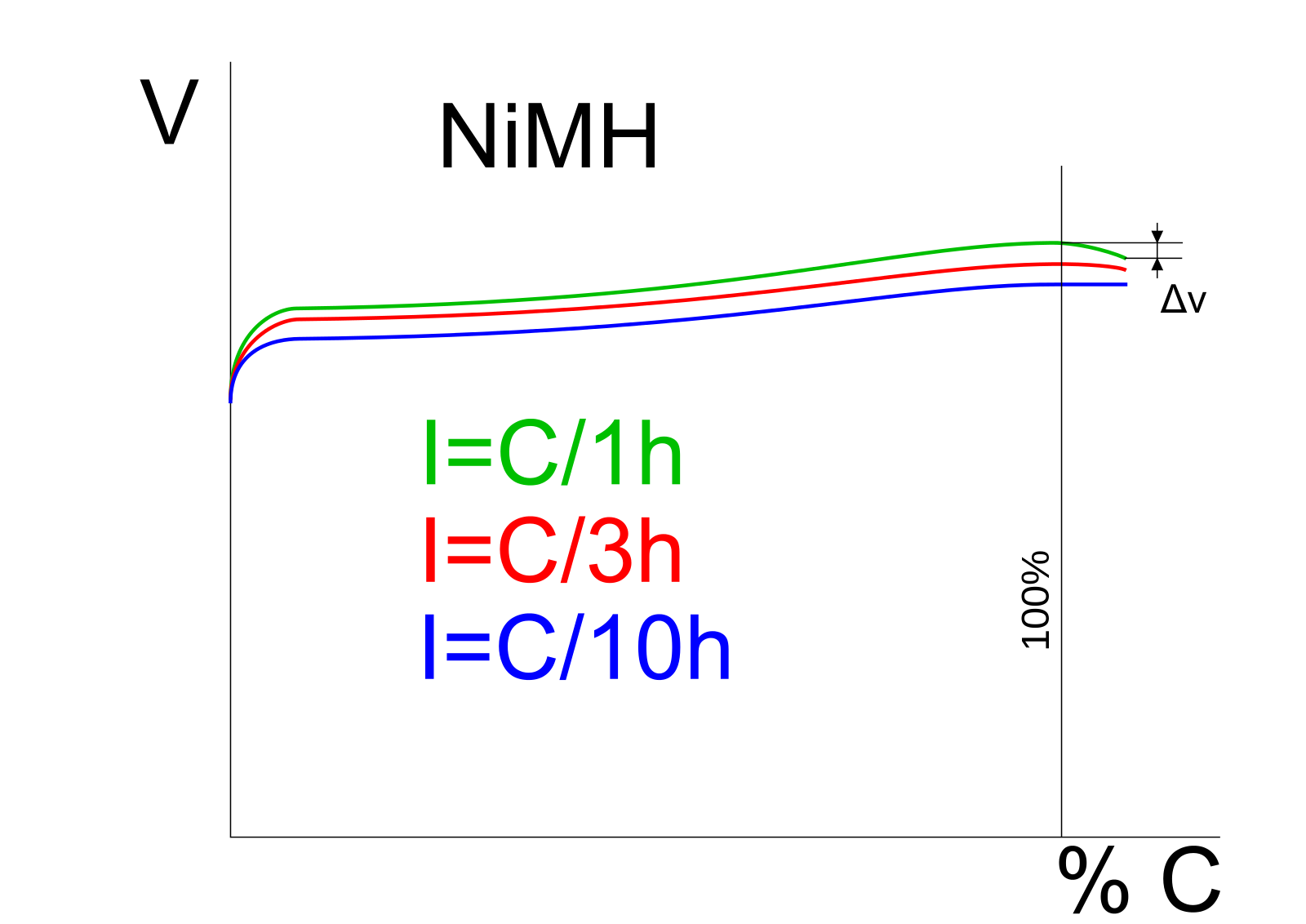 Элементарный никель очень редко встречается вместе с железом в земных и метеоритных отложениях. Металл был выделен (1751 г.) шведским химиком и минералогом бароном Акселем Фредриком Кронштедтом, который приготовил неочищенный образец из руды, содержащей никколит (арсенид никеля). Ранее руда этого же типа называлась Kupfernickel в честь «Старого Ника» и его озорных гномов, потому что, хотя он и напоминал медную руду, но давал хрупкий, незнакомый металл. Вдвое больше, чем медь, никель составляет около 0,007 процента земной коры; это довольно распространенный компонент магматических пород, хотя очень немногие месторождения по концентрации, размеру и доступности могут представлять коммерческий интерес. Считается, что центральные районы Земли содержат значительные количества. Важнейшие источники — пентландит, встречающийся с никельсодержащим пирротином, некоторые разновидности которого содержат 3—5% никеля, и халькопирит, а также никельсодержащие латериты (гарниерит — магниево-никелевый силикат переменного состава).
Элементарный никель очень редко встречается вместе с железом в земных и метеоритных отложениях. Металл был выделен (1751 г.) шведским химиком и минералогом бароном Акселем Фредриком Кронштедтом, который приготовил неочищенный образец из руды, содержащей никколит (арсенид никеля). Ранее руда этого же типа называлась Kupfernickel в честь «Старого Ника» и его озорных гномов, потому что, хотя он и напоминал медную руду, но давал хрупкий, незнакомый металл. Вдвое больше, чем медь, никель составляет около 0,007 процента земной коры; это довольно распространенный компонент магматических пород, хотя очень немногие месторождения по концентрации, размеру и доступности могут представлять коммерческий интерес. Считается, что центральные районы Земли содержат значительные количества. Важнейшие источники — пентландит, встречающийся с никельсодержащим пирротином, некоторые разновидности которого содержат 3—5% никеля, и халькопирит, а также никельсодержащие латериты (гарниерит — магниево-никелевый силикат переменного состава).
Викторина по Британике
Факты, которые вы должны знать: Викторина по периодической таблице
Металлургия никеля сложна в деталях, многие из которых сильно различаются в зависимости от конкретной обрабатываемой руды. Как правило, руда превращается в трисульфид диникеля Ni 2 S 3 (с никелем в степени окисления +3), который обжигается на воздухе с получением оксида никеля NiO (состояние +2), который затем восстанавливается углеродом с получением металла. Некоторое количество никеля высокой чистоты получают с помощью упомянутого ранее карбонильного процесса. (Для получения информации о добыче, переработке и производстве никеля, см. обработка никеля.)
Никель (атомный номер 28) напоминает железо (атомный номер 26) по прочности и ударной вязкости, но больше похож на медь (атомный номер 29) по стойкости к окислению и коррозии, что объясняет многие его применения. Никель обладает высокой электро- и теплопроводностью. Более половины произведенного никеля используется в сплавах с железом (особенно в нержавеющих сталях), а большая часть остального используется в коррозионно-стойких сплавах с медью (включая монель, который содержит около 60–70% никеля, 30–40% медь и небольшое количество других металлов, таких как железо) и в жаропрочных сплавах с хромом. Никель также используется в электрически резистивных, магнитных и многих других сплавах, таких как нейзильбер (с медью и цинком, но без серебра). Нелегированный металл используется для формирования защитных покрытий на других металлах, особенно гальванопокрытием. Мелкодисперсный никель используется для катализа гидрирования ненасыщенных органических соединений (например, жиров и масел).
Более половины произведенного никеля используется в сплавах с железом (особенно в нержавеющих сталях), а большая часть остального используется в коррозионно-стойких сплавах с медью (включая монель, который содержит около 60–70% никеля, 30–40% медь и небольшое количество других металлов, таких как железо) и в жаропрочных сплавах с хромом. Никель также используется в электрически резистивных, магнитных и многих других сплавах, таких как нейзильбер (с медью и цинком, но без серебра). Нелегированный металл используется для формирования защитных покрытий на других металлах, особенно гальванопокрытием. Мелкодисперсный никель используется для катализа гидрирования ненасыщенных органических соединений (например, жиров и масел).
Никель
можно легко изготовить с использованием стандартных методов горячей и холодной обработки. Никель медленно реагирует с фтором, в конечном итоге образуя защитное покрытие из фторида, и поэтому используется в чистом виде или в виде сплавов, таких как монель, в оборудовании для работы с газообразным фтором и коррозионно-активными фторидами. Никель ферромагнитен при обычных температурах, хотя и не так сильно, как железо, и менее электроположителен, чем железо, но легко растворяется в разбавленных минеральных кислотах.
Никель ферромагнитен при обычных температурах, хотя и не так сильно, как железо, и менее электроположителен, чем железо, но легко растворяется в разбавленных минеральных кислотах.
Природный никель состоит из пяти стабильных изотопов: никеля-58 (68,27%), никеля-60 (26,10%), никеля-61 (1,13%), никеля-62 (3,59%) и никеля-64 (0,91%). Он имеет гранецентрированную кубическую кристаллическую структуру. Никель ферромагнитен до 358 ° C или 676 ° F (точка Кюри). Металл обладает уникальной стойкостью к действию щелочей и часто используется для изготовления емкостей для концентрированных растворов едкого натра. Никель медленно реагирует с сильными кислотами в обычных условиях с выделением водорода и образованием Ni 2 + ионы.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подписаться сейчас
Китай является крупнейшим в мире производителем никеля. Другие крупные страны-производители никеля включают Россию, Японию, Австралию и Канаду.
Соединения
В своих соединениях никель проявляет степени окисления -1, 0, +1, +2, +3 и +4, хотя состояние +2 является наиболее распространенным. Ni 2+ образует большое количество комплексов, охватывающих координационные числа 4, 5 и 6 и все основные структурные типы, например октаэдрические, тригонально-бипирамидальные, тетраэдрические и квадратные.
Соединения с никелем в состоянии +2 имеют множество промышленных применений. Например, хлорид никеля, NiCl 2 , нитрат никеля, Ni(NO 3 ) 2 ·6H 2 O, и сульфамат никеля, Ni(SO 3 NH 2 ) 2 ∙ 4H 2 O, используются главным образом в ваннах для гальваники никеля. Сульфат никеля, NiSO 4 , также используется при никелировании, а также при приготовлении катализаторов, грунтовых эмалей и протрав (закрепителей) для окрашивания и текстильной печати. Оксид никеля, NiO, и пероксид никеля, Ni 2 O 3 , подготовлены для использования в топливных элементах и аккумуляторных батареях соответственно. Ферриты никеля используются в качестве магнитных сердечников для различных типов электрооборудования, таких как антенны и трансформаторы.
Ферриты никеля используются в качестве магнитных сердечников для различных типов электрооборудования, таких как антенны и трансформаторы.
Типичными соединениями никеля в природе, в которых он встречается главным образом в виде минералов в сочетании с мышьяком, сурьмой и серой, являются сульфид никеля, NiS; арсенид никеля, NiAs; антимонид никеля, NiSb; диарсенид никеля, NiAs 2 ; тиоарсенид никеля, NiAsS; и тиоантимонид никеля, NiSbS. В сульфиде никель находится в степени окисления +2, а во всех других приведенных соединениях — в степени +3.
Среди других важных коммерческих соединений карбонил никеля или тетракарбонилникель, Ni(CO) 4 . Это соединение, в котором никель проявляет нулевую степень окисления, используется главным образом как носитель оксида углерода при синтезе акрилатов (соединений, используемых в производстве пластмасс) из ацетилена и спиртов. Это было первое открытое из класса соединений, называемых карбонилами металлов (1890 г. ). Бесцветная летучая жидкость образуется при воздействии монооксида углерода на мелкодисперсный никель и характеризуется электронной конфигурацией, в которой атом никеля окружен 36 электронами. Этот тип конфигурации вполне сравним с конфигурацией атомов инертных газов.
). Бесцветная летучая жидкость образуется при воздействии монооксида углерода на мелкодисперсный никель и характеризуется электронной конфигурацией, в которой атом никеля окружен 36 электронами. Этот тип конфигурации вполне сравним с конфигурацией атомов инертных газов.
Редакторы Британской энциклопедии
Эта статья была недавно пересмотрена и обновлена Адамом Августином.
BU-407: Зарядка никель-кадмиевых аккумуляторов — Battery University
Аккумуляторы на основе никеля сложнее заряжать, чем литий-ионные и свинцово-кислотные. Системы на основе лития и свинца заряжаются регулируемым током, чтобы довести напряжение до установленного предела, после чего батарея насыщается до полной зарядки. Этот метод называется постоянным током и постоянным напряжением (CCCV). Батареи на основе никеля также заряжаются постоянным током, но напряжение может свободно повышаться. Обнаружение полного заряда происходит путем наблюдения за небольшим падением напряжения после устойчивого роста. Это может быть связано с периодом плато и повышением температуры во времени (подробнее ниже).
Это может быть связано с периодом плато и повышением температуры во времени (подробнее ниже).
Производители аккумуляторов рекомендуют медленно заряжать новые аккумуляторы в течение 16–24 часов перед использованием. Медленная зарядка приводит все элементы аккумуляторной батареи к одинаковому уровню заряда. Это важно, потому что каждая ячейка в никель-кадмиевой батарее может саморазряжаться со своей скоростью. Кроме того, при длительном хранении электролит имеет тенденцию оседать на дне элемента, а начальная медленная зарядка способствует перераспределению для устранения сухих пятен на сепараторе. (См. также BU-803a: Потеря электролита)
Производители аккумуляторов не полностью форматируют никелевые и свинцовые аккумуляторы перед отправкой. Элементы достигают оптимальной производительности после заполнения, которое включает несколько циклов заряда/разряда. Это часть нормального использования; это также можно сделать с помощью анализатора аккумуляторов. Известно, что качественные ячейки полностью соответствуют техническим характеристикам уже после 5–7 циклов; другим может потребоваться 50–100 циклов.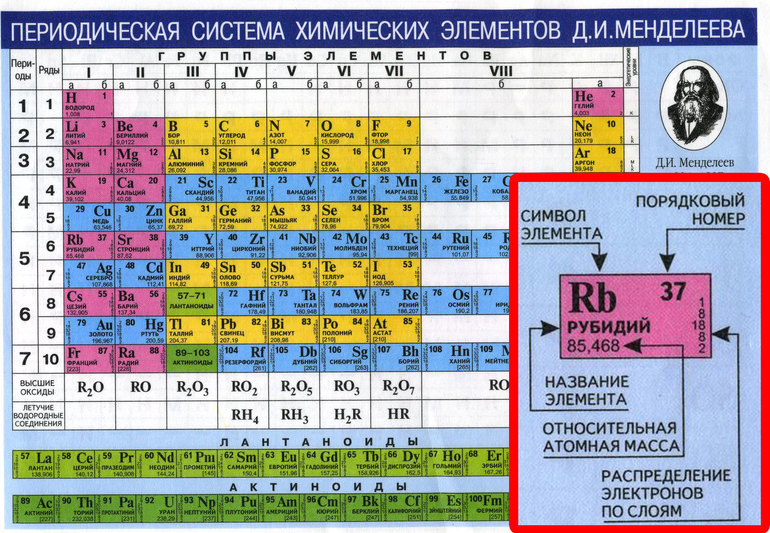 Пиковая мощность возникает между 100–300 циклами, после чего производительность начинает постепенно падать.
Пиковая мощность возникает между 100–300 циклами, после чего производительность начинает постепенно падать.
Большинство перезаряжаемых элементов имеют предохранительный клапан, который сбрасывает избыточное давление в случае неправильной зарядки. Вентиляционное отверстие в элементе NiCd открывается при 1000–1400 кПа (150–200 фунтов на квадратный дюйм). Давление, сбрасываемое через повторно закрывающееся отверстие, не вызывает повреждений; однако при каждом выпуске воздуха некоторое количество электролита вытекает, и уплотнение может начать протекать. Это видно по образованию белого порошка на вентиляционном отверстии. Многократное вентилирование в конечном итоге приводит к высыханию. Аккумулятор никогда не должен подвергаться стрессу до точки вентилирования.
Определение полного заряда по температуре
Определение полного заряда герметизированных никелевых аккумуляторов является более сложным, чем у свинцово-кислотных и литий-ионных. Недорогие зарядные устройства часто используют измерение температуры для прекращения быстрой зарядки, но это может быть неточным.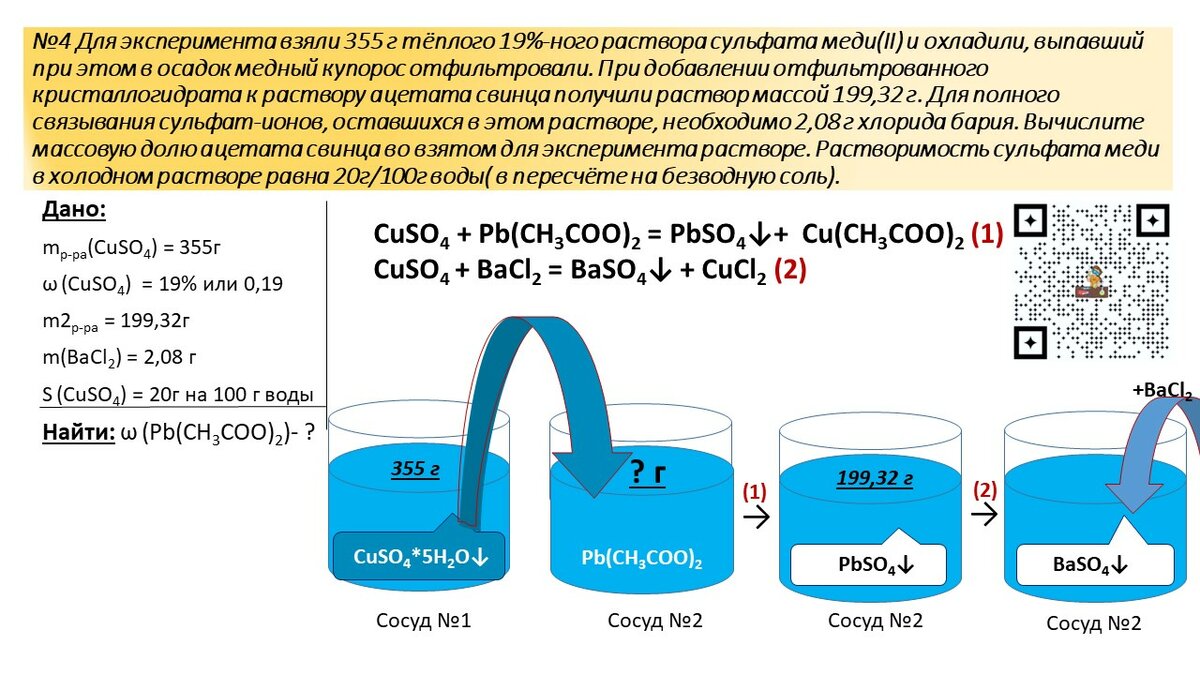 Ядро клетки на несколько градусов теплее, чем кожа, где измеряется температура, и возникающая задержка вызывает перезаряд. Производители зарядных устройств используют 50°C (122°F) в качестве температуры отсечки. Хотя любая длительная температура выше 45°C (113°F) вредна для аккумулятора, кратковременное превышение допустимо, если температура аккумулятора быстро падает, когда появляется индикатор готовности.
Ядро клетки на несколько градусов теплее, чем кожа, где измеряется температура, и возникающая задержка вызывает перезаряд. Производители зарядных устройств используют 50°C (122°F) в качестве температуры отсечки. Хотя любая длительная температура выше 45°C (113°F) вредна для аккумулятора, кратковременное превышение допустимо, если температура аккумулятора быстро падает, когда появляется индикатор готовности.
Усовершенствованные зарядные устройства больше не полагаются на фиксированный порог температуры, но определяют скорость повышения температуры с течением времени, также известную как дельта температуры по дельта времени или dT/dt. Вместо того, чтобы ждать абсолютного значения температуры, dT/dt использует быстрое повышение температуры к концу заряда, чтобы активировать индикатор готовности. Метод дельта-температуры поддерживает более низкую температуру батареи, чем фиксированная температура отсечки, но элементы должны заряжаться достаточно быстро, чтобы вызвать повышение температуры. Прекращение зарядки происходит, когда температура поднимается на 1°C (1,8°F) в минуту. Если батарея не может достичь необходимого повышения температуры, абсолютная отсечка температуры, установленная на 60°C (140°F), прекращает зарядку.
Прекращение зарядки происходит, когда температура поднимается на 1°C (1,8°F) в минуту. Если батарея не может достичь необходимого повышения температуры, абсолютная отсечка температуры, установленная на 60°C (140°F), прекращает зарядку.
Зарядные устройства, зависящие от температуры, вызывают опасные перезарядки, когда полностью заряженный аккумулятор неоднократно вынимается и снова вставляется. Это относится к зарядным устройствам в транспортных средствах и настольным станциям, где двусторонняя радиосвязь отсоединяется при каждом использовании. Повторное подключение инициирует новый цикл зарядки, который требует повторного нагрева батареи.
Литий-ионные системы имеют преимущество в том, что напряжение влияет на состояние заряда. При повторной установке полностью заряженной литий-ионной батареи напряжение сразу же достигает порога полного заряда, ток падает, и зарядное устройство отключается на короткое время без необходимости создания температурной сигнатуры.
Обнаружение полного заряда по сигнатуре напряжения
Усовершенствованные зарядные устройства прекращают зарядку при появлении определенной сигнатуры напряжения. Это обеспечивает более точное определение полного заряда никелевых аккумуляторов, чем температурные методы. Зарядное устройство ищет падение напряжения, которое происходит, когда батарея полностью заряжена. Этот метод называется отрицательной дельта V (NDV).
Это обеспечивает более точное определение полного заряда никелевых аккумуляторов, чем температурные методы. Зарядное устройство ищет падение напряжения, которое происходит, когда батарея полностью заряжена. Этот метод называется отрицательной дельта V (NDV).
NDV — рекомендуемый метод определения полного заряда для зарядных устройств, использующих скорость заряда 0,3C и выше. Он предлагает быстрое время отклика и хорошо работает с частично или полностью заряженной батареей. При установке полностью заряженной батареи напряжение на клеммах быстро возрастает, а затем резко падает, что приводит к переходу в состояние готовности. Зарядка длится всего несколько минут, а элементы остаются прохладными. Зарядные устройства NiCd с обнаружением NDV обычно реагируют на падение напряжения 5 мВ на элемент.
Для получения надежной сигнатуры напряжения скорость заряда должна быть 0,5C и выше. Более медленная зарядка приводит к менее выраженному падению напряжения, особенно если ячейки несовместимы, и в этом случае каждая ячейка достигает полного заряда в разный момент времени.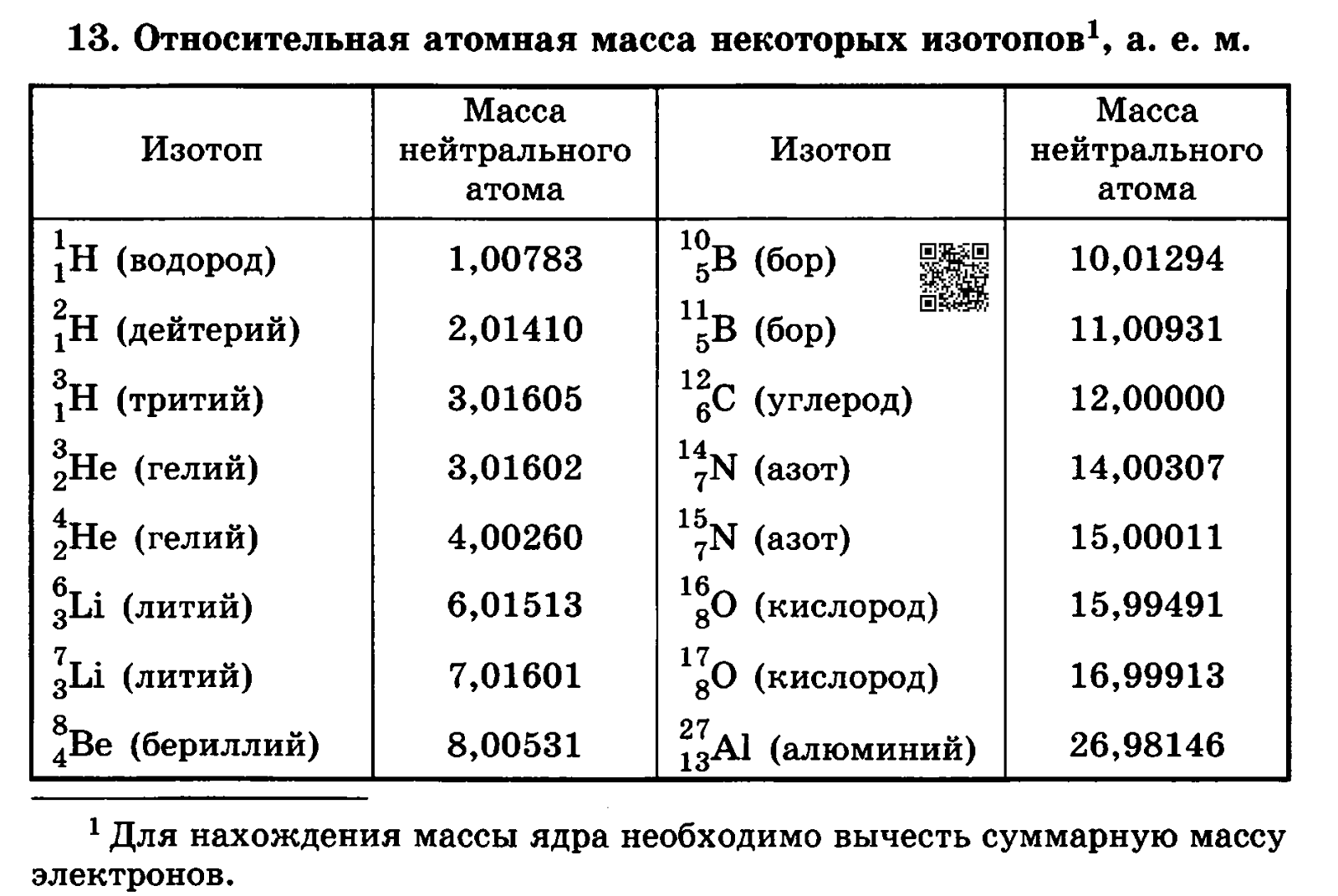 Чтобы обеспечить надежное обнаружение полного заряда, в большинстве зарядных устройств NDV также используется детектор плато напряжения, который прекращает зарядку, когда напряжение остается в стабильном состоянии в течение заданного времени. Эти зарядные устройства также включают дельта-температуру, абсолютную температуру и таймер тайм-аута.
Чтобы обеспечить надежное обнаружение полного заряда, в большинстве зарядных устройств NDV также используется детектор плато напряжения, который прекращает зарядку, когда напряжение остается в стабильном состоянии в течение заданного времени. Эти зарядные устройства также включают дельта-температуру, абсолютную температуру и таймер тайм-аута.
Быстрая зарядка повышает эффективность зарядки. При скорости заряда 1C эффективность стандартного NiCd составляет 91 процент, а время зарядки составляет около часа (66 минут при 91 проценте). При медленном заряде эффективность падает до 71%, что увеличивает время зарядки примерно до 14 часов при 0,1°C.
В течение первых 70 процентов заряда эффективность NiCd приближается к 100 процентам. Аккумулятор поглощает почти всю энергию, а рюкзак остается прохладным. NiCd аккумуляторы, предназначенные для быстрой зарядки, могут заряжаться токами, в несколько раз превышающими C-рейтинг, без значительного накопления тепла. Фактически, NiCd — единственный аккумулятор, который можно сверхбыстро заряжать с минимальным напряжением. Аккумуляторы, предназначенные для сверхбыстрой зарядки, могут быть заряжены до 70 процентов за считанные минуты.
Аккумуляторы, предназначенные для сверхбыстрой зарядки, могут быть заряжены до 70 процентов за считанные минуты.
На рис. 1 показана зависимость напряжения ячейки, давления и температуры при зарядке NiCd. Все идет хорошо примерно до 70 процентов заряда, когда эффективность зарядки падает. Клетки начинают выделять газы, давление повышается, а температура быстро растет. Чтобы снизить нагрузку на батарею, некоторые зарядные устройства снижают скорость зарядки выше 70-процентной отметки.
Рис. 1: Зарядные характеристики NiCd-элемента [1]
Эффективность зарядки высока до 70% SoC*, после чего прием заряда падает. NiMH похож на NiCd. Эффективность заряда измеряет способность батареи принимать заряд и имеет сходство с кулоновской эффективностью.
* SoC относится к относительному состоянию заряда (RSoC), отражающему реальную энергию, которую может хранить аккумулятор. Полный заряд покажет 100%, даже если емкость исчезла. (См. BU-105: Определение батареи и что они означают)
(См. BU-105: Определение батареи и что они означают)
NiCd батареи сверхвысокой емкости имеют тенденцию нагреваться больше, чем стандартные NiCd батареи, при зарядке на 1C и выше, и это отчасти связано с повышенным внутренним сопротивлением. Применение высокого тока при начальной зарядке, а затем постепенное снижение до более низкого уровня по мере снижения приема заряда, является рекомендуемым методом быстрой зарядки для этих более хрупких аккумуляторов. (См. BU-208: Производительность цикла)
Известно, что чередование разрядных импульсов между зарядными импульсами улучшает восприятие заряда никелевыми батареями. Этот метод, обычно называемый зарядом «отрывом» или «обратной загрузкой», способствует рекомбинации газов, образующихся во время заряда. Результатом является более холодная и эффективная зарядка, чем при использовании обычных зарядных устройств постоянного тока. Также говорят, что этот метод уменьшает эффект «памяти», поскольку батарея работает с импульсами. (См. BU-807: Как восстановить аккумуляторы на основе никеля.) Хотя импульсная зарядка может быть полезной для NiCd и NiMH аккумуляторов, этот метод не применим к системам на основе свинца и лития. Эти батареи лучше всего работают с чистым постоянным напряжением.
BU-807: Как восстановить аккумуляторы на основе никеля.) Хотя импульсная зарядка может быть полезной для NiCd и NiMH аккумуляторов, этот метод не применим к системам на основе свинца и лития. Эти батареи лучше всего работают с чистым постоянным напряжением.
После полной зарядки NiCd-аккумулятор получает непрерывный заряд 0,05–0,1C для компенсации саморазряда. Чтобы уменьшить возможный перезаряд, разработчики зарядных устройств стремятся к минимально возможному току непрерывного заряда. Несмотря на это, лучше не оставлять аккумуляторы на основе никеля в зарядном устройстве более чем на несколько дней. Снимите их и перезарядите перед использованием.
Зарядка залитых никель-кадмиевых аккумуляторов
Залитые никель-кадмиевые аккумуляторы заряжаются постоянным током примерно до 1,55 В/элемент. Затем ток снижается до 0,1C, и зарядка продолжается до тех пор, пока снова не будет достигнуто 1,55 В/ячейка. В этот момент применяется струйный заряд, и напряжению позволяют свободно плавать.