Как покрыть медью металл: простой способ в домашних условиях
Содержание
Меднение в домашних условиях — гальваника медью: сталь, вольфрам
-
Главная
» -
Наши технологии
» -
Меднение
» -
Меднение в домашних условиях
»
Содержание статьи:
- Гальваника медью в домашних условиях: общие сведения
- Необходимые инструменты
- Подготовка материала
- Как правильно подготовить электролит
- Подготовка материала для меднения
- Техника безопасности
- Гальваника в домашних условиях: меднение
- Метод погружения
- Покрытие без погружения
- Особенности гальванопластики
Меднение в домашних условиях – это технологический процесс, позволяющий наносить на металл, а также другие материалы (вольфрам, сталь) слой меди толщиной от 1 до 300 мкм. Покрытие медным слоем обеспечивает хорошую адгезию металла и при увеличении толщины покрытий придает блеск изделиям, устраняет небольшие дефекты, позволяет создавать копии вещи. Удивительно, но все это можно делать и самим. Сегодня мы расскажем, как осуществить меднение металла в домашних условиях.
Покрытие медным слоем обеспечивает хорошую адгезию металла и при увеличении толщины покрытий придает блеск изделиям, устраняет небольшие дефекты, позволяет создавать копии вещи. Удивительно, но все это можно делать и самим. Сегодня мы расскажем, как осуществить меднение металла в домашних условиях.
Гальваника медью в домашних условиях: общие сведения
С технической точки зрения обработка – это электрохимический процесс. В процессе всегда есть два «участника» анод+электролит (источник металла) и деталь.
Технология гальваники медью в домашних условиях достаточно проста. Заключается она в том, что за счет электролита и проводимого через него тока выделяются атомы металла. Они оседают на поверхности, образуя медное покрытие.
Среди основных этапов гальванического меднения в домашних условиях:
- Подготовка поверхности (механическая и химическая).
- Нанесение подслойного покрытия (если необходимо)
- Меднение в соответствующем исходному металлу электролите.

Для декоративного гальванического меднения подойдут электролиты матового и блестящего меднения. После нанесения слоя, можно обработать поверхность в электролитах серебра, золота никеля и т.д.
Необходимые инструменты для меднения в домашних условиях
«Ингредиенты», без которых меднение не состоится, но которые реально подготовить в домашних условиях. Наши гальваники утверждают, что прежде всего, нужны:
- Источник постоянного тока.Выбирается в зависимости от размера изделия.
- Аноды. Анодные пластины выполняют несколько функций. В первую очередь, они подводят в электролит ток, во-вторых, они возмещают убыль металла, уходящего на покрытие изделия.
- Рабочий электролит. Кислотный, щелочной или пирофосфорный раствор. Состав электролита выбирается в зависимости от исходного металла. Необходимо помнить, что любой электролит не универсален и подойдет не для всех работ.
Подготовка материала
Как правильно подготовить простой электролит меднения
Стоит отметить, что гальваника в домашних условиях медью сложна, потому что химические реактивы найти непросто. Компании, реализующие подобные продукты, не продают их без специальных документов. Но вы можете сделать все сами.
Компании, реализующие подобные продукты, не продают их без специальных документов. Но вы можете сделать все сами.
Электролит в домашних условиях возможно приготовить только при условии точного соблюдения рецептуры. В состав простейшего электролита входит:
- Дистиллированная вода (или бидистиллят).
- Медный купорос.
- Соляная или другая кислота.
Готовый раствор имеет яркий синий цвет, запаха нет. Допускается наличие некоторого осадка. Важно соблюдать все меры безопасности с химическими реактивами, особенно в домашних условиях: защита рук и глаз в первую очередь. Одежду, на которую случайно мог пролиться раствор, – лучше перевести в разряд дачной.
Хранить такую жидкость лучше в стеклянных бутылках или пластиковых канистрах, а также обязательно указать дату розлива и название раствора. Правильное хранение компонентов избавит вас от возможных проблем. Приготовление электролита должно проходить в чистой пластмассовой или стеклянной посуде.
Подготовка материала для меднения в домашних условиях
Химическое меднение — это альтернатива электрохимическому способу, но не всегда может его заменить.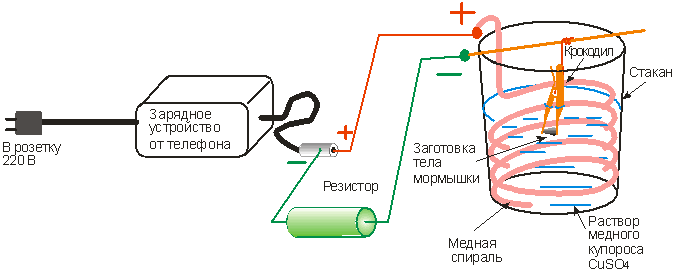 В этом процессе важно тщательно подготовить деталь, бесследно устранив царапины, загрязнения, сколы и т.д. Для того, чтобы обезжирить вещь, можно пускать в ход и чистые растворители, и обезжиривающие растворы.
В этом процессе важно тщательно подготовить деталь, бесследно устранив царапины, загрязнения, сколы и т.д. Для того, чтобы обезжирить вещь, можно пускать в ход и чистые растворители, и обезжиривающие растворы.
При этом универсального метода нет – разные виды металла подвергаются очистке по-разному:
- Сталь. Обезжиривать сталь можно раствором, содержащим едкий натрий и едкий калий при 70-90 градусов по Цельсию. Это займет около 20-30 минут. Будьте аккуратны, пользуйтесь вытяжкой.
- Медь и сплавы. Обезжиривание осуществляется едким натрием, нагретым предварительно до 40°, около 10 минут.
- Чугун. Для процесса обезжиривания нужен раствор, содержащий едкий натрий, жидкое стекло, карбонат натрия и фосфат натрия при нагревании до 90°.
- Вольфрам. Меднение вольфрама в домашних условиях начинается с чистки предмета от грязи и прочих дефектов наждачной бумагой.
Техника безопасности при меднении в домашних условиях
Несмотря на возможность гальваники в домашних условиях (меднения), процесс остается опасным. В любом гальваническом процессе задействованы токсичные вещества, способные сильно нагреваться. Поэтому нужно неукоснительно соблюдать меры предосторожности.
В любом гальваническом процессе задействованы токсичные вещества, способные сильно нагреваться. Поэтому нужно неукоснительно соблюдать меры предосторожности.
Первое правило гальваники медью в домашних условиях – работайте только в нежилом, хорошо проветриваемом помещении. Подойдут такие места, как мастерская или гараж. Второе правило – применяемое оборудование нужно заземлить. Третье – это соблюдение личной безопасности.
Для обеспечения собственной защиты при меднении в домашних условиях нужно:
- Постоянно быть в респираторе, чтобы обезопасить дыхательные пути. лучше всего использовать вытяжку.
- Защитить руки прочными прорезиненными перчатками.
- Надеть специальную форму или клеенчатый фартук, противоожоговую обувь.
- Не забыть очки для безопасности зрительных органов.
- Не приносить в помещение еду и питье.
Перед меднением лучше заранее озаботиться прочтением специализированной литературы по данной теме. Желательно посоветоваться со специалистами данного профиля.
Гальваника в домашних условиях: меднение
Почему в гальванике столь востребована именно медь? Она имеет высокую адгезию (иными словами – сцепление) к самым разным материалам. Это значит, что она превосходно держится на изделиях из стали, вольфрама, не отлетая и не скалываясь.
Медь – красивый яркий металл, внешне напоминает самородки розово-красного оттенка. Материал проводит не только тепло, но и электрический ток – отсюда и высокий спрос в сфере электротехники и приборостроении. Однако чистую медь найти сложно. Чаще она поставляется с различными примесями.
Медные покрытия:
- Отличаются малым сопротивлением, что используется в электротехнике
- Скрывает мелкие недочеты поверхности.
- Быстро окисляется, что используют для получения эффекта «антик».
Технологий меднения существует две. Одна происходит путем погружения изделия в раствор электролиты (с подачей тока или без). Второй же способ – это метод селективного нанесения покрытия без погружения в раствор. Рассмотрим оба.
Рассмотрим оба.
Метод погружения
В домашних условиях поверхность, подвергаемую гальванике, следует скрупулезно образом обработать. Например, наждачной бумагой и щеточкой. После обязательно обезжирьте деталь и промойте.
Дальше:
- Анодную пластину (можно две) помещают в емкость, которую будем называть ванной. На аноды замыкают положительную клемму.
- Между анодами на любом удобном проводнике подвешивается деталь, к ней подводят отрицательный полюс от блока питания.
- Готовый раствор вливается в ванночку – при этом уровень покрытия должен быть выше, чем расположена деталь.
- После подключения электродов к источнику тока выставляют рабочий ток. Это примерно 1 А/кв.дм. покрытия.
Продолжительность работы зависит от необходимой толщины слоя, обычно от 5 минут.
Покрытие без погружения
Данный способ меднения имеет ограничения – чаще всего он подходит для реставрации поверхности. Таким способом можно нанести только небольшую толщину металла. Нет смысла покрывать таким методом изделия, которые можно меднить в ванне.
Нет смысла покрывать таким методом изделия, которые можно меднить в ванне.
Порядок действий при гальваническом меднении в домашних условиях:
- Готовят «тампон» для нанесения покрытия. Берут медный проводник и наматывают кусок искусственной ткани (полиэстер подойдет).
- Противоположный конец проводника подсоединяют к положительной клемме источника напряжения.
- Электролитным раствором наполняют емкость – так удобнее окунать карандаш.
- Деталь аккуратно очищают и обезжиривают, а потом помещают в пустую ванночку. Там изделие подсоединяется к отрицательной клемме.
- Тампон смачивают в растворе. Затем им проводят по поверхности изделия, закрашивая ее постепенно.
Процесс длится до полного покрытия медным слоем изделия.
Особенности гальванопластики в домашних условиях
Гальванопластика — это процесс нанесения меди на проводящую или непроводящую поверхность изделия с последующим снятием покрытия с негативной матрицы. Таким образом можно получить множество очень точных копий с одного изделия. При этом, есть условие: наращивание меди толщиной не менее 200 мкм, чтобы изделие получилось прочным.
При этом, есть условие: наращивание меди толщиной не менее 200 мкм, чтобы изделие получилось прочным.
Важно учесть, что, если поверхность изделия не имеет свойств проводника, то потребуется больше усилий – а именно, особое предварительное покрытие графитом, серебром или медью. Основным металлом для осуществления гальванопластики считается медь, но можно выращивать матрицы из серебра чистотой 9999.
Обучение гальванике
Можно сделать вывод, что меднение сегодня — это один из наиболее актуальных гальванотехнических процессов, обучиться которому может каждый. Компания «6 микрон» проводит обучение по направлению «Гальваника» для всех желающих! Вы сможете выбрать удобную для Вас программу обучения, которая лучше всего подойдет для гальваники в домашних условиях и не только. Все интересующие вопросы можно задать по телефону или по электронной почте, наши технологи проконсультируют по курсам для обучения.
Видео руководство по меднению деталей в домашних условиях:
youtube.com/embed/YktqT_HiC3E?ecver=1″ frameborder=»0″ allowfullscreen=»allowfullscreen»>
Подробности Вы можете узнать по ссылке://6mkm.ru/uslugi/obuchenie-komplekti-dlya-prodazhi/
Гордиенко Анастасия Вадимовна
Автор материалов
Должность: главный технолог ООО «6 микрон»
Образование: высшее
Опыт работы в гальванике: 13 лет
При оформлении заказа онлайн скидка 10 %!
Наш приоритет — индивидуальный подход к каждому заказу и качество выполняемых работ!
Отправить заявку или задать вопрос:
Ваше имя
Ваш e-mail
Ваш телефон *
Сообщение
Текст с картинки *
Смотрите также:
Меднение
10000
С ценами на услуги по гальваническому меднению можно ознакомиться в конце этой статьи.
 Процесс гальванического меднения в большинстве случаев является…
Процесс гальванического меднения в большинстве случаев является…Tags: покрытия, меднение, меднения, изделия
Меднение металлов
10000
Медь – один из первых материалов, которые смог «приручить» человек. Открытый около четырех тысяч лет назад, этот материал сегодня сохраняет…
Tags: меднение, меднения, покрытия, металла
Типы меднения
10000
Медные покрытия редко используются как самостоятельные – в основном они нужны для промежуточных слоев перед никелированием, хромированием, серебрением. При этом…
Tags: меднение, покрытия, меднения
Очень простой способ меднения предметов
… Иногда это не только «красиво» но и полезно!
Идея не новая (и не моя)-заинтересовало практическое применение в быту, особенно учитывая необычную простоту процесса и доступность всех необходимых компонентов.
Начну, пожалуй, с рецепта изготовления «напитка»: компонентов минимум…
| Понадобиться обычный медный купорос, электролит (из автомагазина) и |
| 50 грамм купороса необходимо размешать в 200-250 граммах воды |
Тщательно перемешиваем и осторожно доливаем 50 грамм электролита |
Полученный раствор можно хранить в этой же бутылочке, он не разлагается и не теряет своих свойств в течении длительного времени |
░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░
Практическое применение изготовленного раствора может быть довольно разнообразным:
░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░
✅ Например, хранящиеся в сарайчике сверла/метчики/развертки со временем покрылись следами коррозии. Этого можно избежать, если покрыть их тонким слоем меди.
Этого можно избежать, если покрыть их тонким слоем меди.
Для эксперимента возьмем пару метчиков.
легким движением руки…
получаем такой результат.
Слишком толстый слой покрытия нам не нужен, он будет хуже держаться, поэтому достаточно буквально нескольких секунд обработки.
После процедуры деталь должна высохнуть, чтобы прекратилась реакция и медь «прилипла» к стали.
| Прочность покрытия, в значительной степени, зависит от качества предварительной подготовки поверхности! |
Самый простой способ обезжиривания детали — |
В идеале, для придания прочности покрытию, сразу после нанесения первого слоя, его оттирают щеточкой в растворе кальцинированной соды, промывают и наносят слой повторно, уже давая ему просохнуть.
✅
В описанном примере, кроме защитных свойств, нанесенный слой способствует более мягкой и легкой работе с метчиком, так как трение меди со сталью в два раза ниже, чем стали со сталью
ИМХО описываемый способ защиты металла не самый плохой и не самый сложный- сама обработка занимает всего несколько секунд (гораздо больше времени потребуется на очистку и обезжиривание).
✅ Металл, кстати, не обязательно окунать в раствор, можно намочить тупфер и им протирать выбранные участки или даже поупражняться в каллиграфии-наносить надписи на металлические поверхности.
✅
Поскольку, при обработке, слой меди оседает равномерно со всех сторон, понравилась идея восстановления прослабленных посадочных мест валов — ведь при подобном «напылении» ось вращения не уходит, а процесс довольно простой и дешевый, не требующий станков и сложных приспособлений
Для эксперимента отшлифовал поверхность вала, чтобы подшипник на нем болтался
пошловатая правда какая-то картинка получилась 🙂
«поврежденное» место многократно опускаю в раствор, до получения желаемой толщины слоя.
При необходимости, лаком/краской можно защитить поверхность или резьбу, на которой слой меди нам не нужен.
После нескольких окунаний в раствор подшипник уже рукой не натягивается — необходимо впрессовывать.
✅
Еще один вариант использования раствора — для декоративной обработки поверхностей.
Макнул пару деталек для пробы. Даже без дополнительной обработки поверхности, выглядит довольно интересно
Пробовал царапать металл- покрытие получается относительно прочное…
✅
Далее… заинтересовала возможность нанесения меди на алюминий и другие металлы.
Захотелось, например, припаять алюминиевую проволоку к болту…
… и это в принципе получилось 🙂
Есть правда нюанс- для нанесения меди на алюминий (и некоторые другие металлы) понадобится небольшая доработка нашей «гальвано-установки». |
На самом деле, емкость с электролитом и заготовкой уже является «батарейкой». При внесении второго электрода в электролит мы видим наличие электрического тока. |
|
Доработанная гальвано-установка, в принципе, работает даже от «повербанки» (проверял) или маломощной зарядки от телефона, но для контроля процесса все же удобнее использовать регулируемый источник тока (при слишком больших токах наносимый слой получается относительно рыхлый, при слишком малых процесс идет крайне медленно, или останавливается).
В зависимости от размеров поверхности, я устанавливал 300-500мА, возможно потребуется подобрать оптимальные значения под конкретную заготовку.
✅
Любопытно, что нанесение покрытия возможно не только на металлы, но и на дерево, засушенные растения, насекомых и прочие неметаллические поверхности.
Подобная возможность просто находка для любителей изготовления различных декоративных предметов.
Технология нанесения не сильно отличается от описанной, просто сначала на поверхность наносится электропроводный лак или графитовый порошок, затем все по описанному выше сценарию. Понадобится некоторая сноровка и (возможно) дополнительные присадки, для получения матового или зеркального покрытия и получения необычных эффектов на поверхности (патинирование и другие).
—под слоем меди находится действительно то, что Вы видите!
-Варианты применения меднения не ограничиваются перечисленными выше, а главный плюс описанной технологии: простота, доступность компонентов и их мизерная стоимость.
Вероятно, описанным методом, при необходимости, можно экранировать небольшой корпус устройства (на манер корпуса ноутбука), металлизировать поверхность, в некоторых случаях восстановить или добавить дорожку на плате, сделать надпись, покрыть ручку аппаратуры в стиле стимпанкМожно покрыть медью кусок свинца и сдать в металлолом :)))и т.п…
Кстати, подобным же образом делают копии отдельных предметов (например редкой монеты) :).
По изготовлению декоративных предметов гальванопластикой тема довольно обширная, и если она интересна моим читателям, опубликую продолжение с подробностями — «историю одного эксперимента :)»
(для одного обзора слишком большой объем информации и картинок.)
На этом пожалуй и все 😉 Надеюсь идея статьи Вам понравилась.
Всем удачи и хорошего настроения!☕
21.12A: Металлическая медь — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 34468
- Роберт Дж.
 Ланкашир
Ланкашир - Университет Вест-Индии в Моне
Информацию об истории меди можно найти в Ассоциации развития меди, Inc., где отмечается, что: «В течение почти 5000 лет медь была единственным металлом, известным человеку. металлы». Люди впервые использовали медь около 10 000 лет назад. Считается, что медный кулон, обнаруженный в Северном Ираке, датируется примерно 8700 годом до нашей эры. Доисторический человек, вероятно, использовал медь для изготовления оружия. Древние египтяне, похоже, тоже ценили коррозионную стойкость металла. Они использовали медные ленты и гвозди в судостроении, а медные трубы использовались для подачи воды. Некоторые из этих артефактов сохранились до наших дней в хорошем состоянии. По оценкам, общий объем производства меди в Египте за 1500 лет составляет 10 000 тонн.
Спустя годы появились медные сплавы. Сначала появились бронзы (сплавы меди и олова), а гораздо позже — латуни (сплавы меди и цинка). В «бронзовом веке» медь и бронза широко использовались для изготовления оружия, монет, домашней утвари, мебели и других предметов. Самым ранним известным примером использования латуни является римская монета, отчеканенная во время правления Августа с 27 г. до н.э. по 14 г. н.э. Позже медь сыграла важную роль в появлении электричества и сегодня по-прежнему остается одним из самых ценных материалов.
Самым ранним известным примером использования латуни является римская монета, отчеканенная во время правления Августа с 27 г. до н.э. по 14 г. н.э. Позже медь сыграла важную роль в появлении электричества и сегодня по-прежнему остается одним из самых ценных материалов.
Использование соединений меди также восходит к периоду до 4000 г. до н.э. Сульфат меди, например, был особенно важным соединением в ранние времена. Древние египтяне использовали его в качестве протравы в процессе окрашивания. Соединение также использовалось для изготовления мазей и других подобных препаратов. Позже медный купорос стал применяться в лечебных целях с его назначением при легочных заболеваниях. Сульфат меди по-прежнему широко используется сегодня, и о вредных побочных эффектах его применения не сообщалось.
Возникновение
Медь является 25-м -м -м наиболее распространенным элементом Земли, но одним из менее распространенных переходных металлов первого ряда. Он встречается в виде мягкого красноватого металла, который можно найти в виде больших валунов весом в несколько сотен тонн или в виде сульфидных руд. Последние представляют собой сложные смеси меди, железа и серы в сочетании с другими металлами, такими как мышьяк, цинк и серебро. Концентрация меди в таких рудах обычно составляет 0,5-2%.
Последние представляют собой сложные смеси меди, железа и серы в сочетании с другими металлами, такими как мышьяк, цинк и серебро. Концентрация меди в таких рудах обычно составляет 0,5-2%.
Самая распространенная руда — халькопирит, CuFeS 2 , медно-желтая руда, на долю которой приходится примерно 50% мировых месторождений меди. Существует множество других медных руд разного цвета и состава. Примерами являются малахит Cu 2 CO 3 (OH) 2 , ярко-зеленая руда и красный рудный куприт Cu 2 O.
Медь встречается в биологических системах как часть простетической группы. определенных белков. Примеры белков, содержащих медь, см. в статье Университета Лидса, факультета биохимии и молекулярной биологии Института Скриппса. Красный пигмент мягкоклювой птицы T(o)uraco содержит медно-порфириновый комплекс. Пигмент хорошо растворяется в воде в щелочных условиях, о чем сообщалось в 1952, попытки работников зоопарка помыть птицу привели к тому, что вода окрасилась в красный цвет. Говорят, что Т(о)урако — единственные птицы, обладающие настоящим красным и зеленым цветом. Как правило, цвет, который вы воспринимаете, наблюдая за птицами, обусловлен отражениями, создаваемыми структурой пера. Красный и зеленый пигменты (турацин и тураковердин), содержащиеся в перьях Т(о)урако, содержат медь.
Говорят, что Т(о)урако — единственные птицы, обладающие настоящим красным и зеленым цветом. Как правило, цвет, который вы воспринимаете, наблюдая за птицами, обусловлен отражениями, создаваемыми структурой пера. Красный и зеленый пигменты (турацин и тураковердин), содержащиеся в перьях Т(о)урако, содержат медь.
Рисунок 2: Мягкоклювая птица T(o)uraco
Добыча меди
Медь извлекается из руды двумя основными способами:
- Пирометаллургический метод
- Гидрометаллургический метод
Пирометаллургический метод
Этот метод часто используется при добыче сульфидных руд. Существует четыре основных этапа:
- Добыча и измельчение: руда дробится и измельчается в порошок, обычно содержащий менее 1% меди. Минералы концентрируются в суспензию, содержащую около 15% меди. Минералы меди отделяют от бесполезного материала флотацией с использованием пенообразующих растворов.
- Плавка: Плавка медного концентрата и экстракция путем нагревания, флюса и добавления кислорода.
 Сера, железо и другие нежелательные элементы удаляются, и продукт называется черновой медью.
Сера, железо и другие нежелательные элементы удаляются, и продукт называется черновой медью. - Рафинирование: это заключительный этап процесса получения высококачественной меди. Используются методы огневого и электрорафинирования. Последний производит медь высокой чистоты, пригодную для использования в электротехнике.
Гидрометаллургический метод -SX/EW
Экстракция растворителем/Электровыделение является наиболее распространенным процессом выщелачивания, используемым в настоящее время для извлечения меди из химических растворов. Как следует из названия, метод включает в себя два основных этапа:
- Экстракция растворителем – процесс, при котором ионы меди выщелачиваются или иным образом извлекаются из сырой руды с использованием химических реагентов.
- Электровыделение – электролиз раствора, содержащего ионы металла, при котором ионы меди в нем осаждаются на катоде, а затем удаляются в виде элемента.
Процесс происходит в следующие этапы:
- Выщелачивающий раствор (выщелачивающий раствор) выбирают для выщелачивания ионов Cu из руды.
 Обычными реагентами являются слабые кислоты, т.е. Н 2 SO 4 , H 2 SO 4 + Fe 2 (SO 4 ) 3 , кислые растворы хлоридов, например FeCl 2 , композиции хлорида аммония и соли аммония.
Обычными реагентами являются слабые кислоты, т.е. Н 2 SO 4 , H 2 SO 4 + Fe 2 (SO 4 ) 3 , кислые растворы хлоридов, например FeCl 2 , композиции хлорида аммония и соли аммония. - При нанесении на руду выбранный выщелачиватель растворяет присутствующие ионы меди с образованием выщелачивающего продукта, называемого «содержащим выщелачивающим раствором».
- Затем выбирают органический экстрагент для удаления ионов меди из водного раствора. Предпочтительные органические экстрагенты состоят из гидроксифенилоксимов, имеющих основную химическую формулу:
- C 6 H 3 (R)(OH) CNOHR*, R= C 9 H 19 или C 12 H 25 и R* или C, CH 3 6 Н 5
Примерами таких экстрагентов являются 5-нонилсалицилальдоксим и смесь этого соединения и 2-гидрокси-5-нонилацетофеноноксима. Имеющиеся в продаже реагенты обычно содержат 5-10% оксима в 90-95%-ном нефтяном разбавителе, таком как керосин.
Имеющиеся в продаже реагенты обычно содержат 5-10% оксима в 90-95%-ном нефтяном разбавителе, таком как керосин.
Перед смешиванием с выщелачивающим продуктом экстрагент будет содержать мало меди или совсем не содержать ее и на данном этапе называется «бесплодным органическим экстрагентом».
- Ионы меди переходят из выщелачивающего раствора в органический экстрагент при смешивании двух реагентов. Происходит разделение фаз с получением водной и органической фаз, называемых соответственно первой водной и первой органической фазами. Первая водная фаза, «рафинат», представляет собой выщелачиватель, лишенный ионов меди, в то время как первая органическая фаза представляет собой «загруженный органический экстрагент», т.е. экстрагент с присутствующими ионами меди.
- Рафинат рециркулируется на площадку выщелачивания, в то время как загруженный органический экстрагент смешивается с раствором электролита, называемым «тощим электролитом» (т.е. не содержащим меди).
 Типичными электролитами являются кислые растворы, такие как серная кислота, H 2 СО 4 . Таким образом, ионы меди, которые присутствовали в органическом экстрагенте, растворяются в растворе электролита, образуя медьсодержащий «богатый электролит». Здесь снова происходит фазовое разделение. Вторая органическая фаза представляет собой обедненный органический экстрагент, тогда как вторая водная фаза представляет собой «богатый электролит». Бесплодный органический экстрагент затем рециркулируют для повторного использования при применении к выщелачивающему продукту.
Типичными электролитами являются кислые растворы, такие как серная кислота, H 2 СО 4 . Таким образом, ионы меди, которые присутствовали в органическом экстрагенте, растворяются в растворе электролита, образуя медьсодержащий «богатый электролит». Здесь снова происходит фазовое разделение. Вторая органическая фаза представляет собой обедненный органический экстрагент, тогда как вторая водная фаза представляет собой «богатый электролит». Бесплодный органический экстрагент затем рециркулируют для повторного использования при применении к выщелачивающему продукту. - Заключительной стадией процесса является электролиз кислого раствора ионов металлов. В результате растворенные ионы меди оседают на катоде, а элементарная медь удаляется. Таким образом, процесс восстановления завершен.
Примечание о примесях
Присутствие взвешенных загрязняющих веществ в системе SX/EW может значительно снизить эффективность ее работы. Такие загрязнители могут попасть в систему из руды или из окружающей среды. Система восприимчива к загрязнению дождем, ветром и другими факторами окружающей среды, поскольку первая защитная оболочка, в которой хранится выщелачивающий продукт, обычно не накрыта и расположена на открытом воздухе. Таким образом, твердые отходы в виде грязи, песка, каменной пыли, растительных остатков, минеральных остатков и взвешенных веществ часто попадают в систему на ранних стадиях и сохраняются на последующих стадиях процесса.
Система восприимчива к загрязнению дождем, ветром и другими факторами окружающей среды, поскольку первая защитная оболочка, в которой хранится выщелачивающий продукт, обычно не накрыта и расположена на открытом воздухе. Таким образом, твердые отходы в виде грязи, песка, каменной пыли, растительных остатков, минеральных остатков и взвешенных веществ часто попадают в систему на ранних стадиях и сохраняются на последующих стадиях процесса.
Влияние этих загрязняющих веществ значительно и включает:
- увеличение времени разделения фаз на стадиях, когда органические и водные растворители смешиваются.
- снижение выхода по току и снижение чистоты гальванического изделия из меди на стадии электролиза.
Отсутствие полного разделения фаз после экстракции приводит к потерям дорогостоящего органического экстрагента, так как большая его часть остается в водном растворе.
В большинстве систем SX/EW для решения этой проблемы введены этапы очистки. В патенте США (номер 573341), например, по меньшей мере часть второй органической фазы фильтруется для удаления твердых загрязняющих примесей перед повторным использованием при обработке выщелачивающего продукта. Таким образом, рециркулируемый органический экстрагент содержит мало или совсем не содержит примесей в зависимости от того, была ли отфильтрована часть второй органической фазы или вся вторая органическая фаза. Было обнаружено, что эта стадия фильтрации значительно повышает эффективность работы, даже когда обрабатывается только часть экстрагента.
В патенте США (номер 573341), например, по меньшей мере часть второй органической фазы фильтруется для удаления твердых загрязняющих примесей перед повторным использованием при обработке выщелачивающего продукта. Таким образом, рециркулируемый органический экстрагент содержит мало или совсем не содержит примесей в зависимости от того, была ли отфильтрована часть второй органической фазы или вся вторая органическая фаза. Было обнаружено, что эта стадия фильтрации значительно повышает эффективность работы, даже когда обрабатывается только часть экстрагента.
Использование меди и ее соединений
Медь на протяжении веков уступает по полезности только железу. Металл и его соединения используются во всех сферах жизни от электротехники до медицины и сельского хозяйства.
Использование металлической меди
Электротехническая промышленность является бенефициаром большей части производства меди в мире. Металл используется в производстве электрических приборов, таких как катоды и провода. Другое использование включает:
Другое использование включает:
- Кровля
- Посуда
- Монеты
- Металлообработка
- Сантехника
- Змеевики для холодильников и кондиционеров
- Сплавы напр. бронза, латунь
Использование соединений меди
Соединения меди наиболее широко используются в сельском хозяйстве. С тех пор как была обнаружена их токсичность для некоторых насекомых, грибков и водорослей, эти соединения использовались в инсектицидах, фунгицидах и для предотвращения развития водорослей в резервуарах с питьевой водой. Поэтому они используются для борьбы с болезнями животных и растений. Удобрения также часто дополняют соединениями меди, т.е. медный купорос для повышения плодородия почвы и, следовательно, ускорения роста сельскохозяйственных культур. Соединения меди также используются в фотографии и в качестве красителей для стекла и фарфора.
Медь для хорошего здоровья
Медь является одним из многих микроэлементов, необходимых для хорошего здоровья. Он является частью простетических групп многих белков и ферментов и, таким образом, необходим для их правильного функционирования. Поскольку организм не может синтезировать медь, ее необходимо принимать с пищей. Орехи, семечки, крупы, мясо (например, печень) и рыба являются хорошими источниками меди.
Он является частью простетических групп многих белков и ферментов и, таким образом, необходим для их правильного функционирования. Поскольку организм не может синтезировать медь, ее необходимо принимать с пищей. Орехи, семечки, крупы, мясо (например, печень) и рыба являются хорошими источниками меди.
Медь также нашла применение в медицине. С давних времен он использовался для лечения ран грудной клетки и очистки воды. Недавно было высказано предположение, что медь помогает предотвратить воспаление, связанное с артритом и другими подобными заболеваниями. Продолжаются исследования лекарственных средств, содержащих медь, для лечения этого и других заболеваний.
Соединения меди
Медь состоит из множества соединений, многие из которых окрашены. Двумя основными степенями окисления меди являются +1 и +2, хотя известны некоторые комплексы +3. Ожидается, что соединения меди (I) будут диамагнитными по своей природе и обычно бесцветны, за исключением случаев, когда цвет возникает в результате переноса заряда или аниона. Ион +1 имеет тетраэдрическую или плоскоквадратную геометрию. В твердых соединениях медь (I) часто находится в более стабильном состоянии при умеренных температурах.
Ион +1 имеет тетраэдрическую или плоскоквадратную геометрию. В твердых соединениях медь (I) часто находится в более стабильном состоянии при умеренных температурах.
Ион меди(II) обычно находится в более стабильном состоянии в водных растворах. Соединения этого иона, часто называемые соединениями меди, обычно окрашены. На них влияют искажения Ян-Теллера, и они демонстрируют широкий спектр стереохимии с преобладанием четырех-, пяти- и шестикоординационных соединений. Ион +2 часто имеет искаженную тетраэдрическую геометрию.
Галогениды меди
Известно, что все галогениды меди(I) существуют, хотя фторид еще не был получен в чистом виде. Хлорангидриды, бромиды и йодиды меди — бесцветные диамагнитные соединения. Они кристаллизуются при обычных температурах со структурой цинковой обманки, в которой атомы Cu тетраэдрически связаны с четырьмя галогенами. Соли хлорида и бромида меди (I) получают кипячением кислого раствора ионов меди (II) в избытке меди. При разбавлении образуется белый CuCl или бледно-желтый CuBr. Добавление растворимого йодида к водному раствору ионов меди(II) приводит к образованию осадка йодида меди(I), который быстро разлагается на Cu(I) и йод.
При разбавлении образуется белый CuCl или бледно-желтый CuBr. Добавление растворимого йодида к водному раствору ионов меди(II) приводит к образованию осадка йодида меди(I), который быстро разлагается на Cu(I) и йод.
Галогениды меди(I) умеренно растворимы в воде, и большая часть меди в водном растворе находится в состоянии Cu(II). Тем не менее, плохая растворимость соединений меди (I) увеличивается при добавлении ионов галогенидов. В таблице ниже показаны некоторые свойства галогенидов меди (I).
| Формула | цвет | МП | БП | м (БМ) | Структура |
|---|---|---|---|---|---|
| CuF 2 | белый | 950разложение | — | 1,5 | |
| CuCl 2 | коричневый | 632 | 993разложить | 1,75 | CdCl 2 |
| CuBr 2 | черный | 498 | — | 1,3 |
Все четыре галогенида меди(II) известны, хотя йодид меди быстро разлагается на йодид меди и йод. Желтый хлорид меди (II) и почти черный бромид меди (II) являются обычными галогенидами. Эти соединения имеют структуру с бесконечными параллельными квадратными полосами CuX 4 единиц. Хлорангидриды и бромиды меди хорошо растворимы в воде и донорных растворителях, таких как ацетон, спирт и пиридин.
Желтый хлорид меди (II) и почти черный бромид меди (II) являются обычными галогенидами. Эти соединения имеют структуру с бесконечными параллельными квадратными полосами CuX 4 единиц. Хлорангидриды и бромиды меди хорошо растворимы в воде и донорных растворителях, таких как ацетон, спирт и пиридин.
Галогениды меди(II) являются умеренными окислителями из-за пары Cu(I)/Cu(II). В воде, где потенциал в значительной степени равен потенциалу аквакомплексов, большой разницы между ними нет, но в неводных средах окислительная (галогенирующая) способность возрастает в ряду;
\[\ce{CuF2 \ll CuCl2 \ll CuBr2}\]
Их можно получить прямой реакцией с соответствующими галогенами:
\[\ce{Cu + F2 → CuF2}\]
\[\ce{Cu + Cl2 / 450 C → CuCl2}\]
\[\ce{Cu + Br2 → CuBr2}\]
В качестве альтернативы они могут быть получены из CuX 2 .aq путем нагревания -> CuX 2
| Формула | цвет | МП | БП | Структура |
|---|---|---|---|---|
| CuCl | белый | 430 | 1359 | — |
| CuBr | белый | 483 | 1345 | — |
| CuI | белый | 588 | 1293 | Цинковая смесь |
Получено восстановлением CuX 2 -> CuX;
, за исключением F, который не был получен в чистом виде.
Обратите внимание, что CuI 2 не был выделен из-за легкости восстановления до CuI.
Оксиды меди
Оксиды меди(I) более стабильны, чем оксиды меди(II) при высоких температурах. Оксид меди(I) встречается в самородном виде в виде красного куприта. В лаборатории восстановление раствора Фелинга восстанавливающим сахаром, таким как глюкоза, дает красный осадок. Тест достаточно чувствителен даже для 1 мг сахара, чтобы получить характерный красный цвет соединения. Закись меди также можно получить в виде желтого порошка контролируемым восстановлением щелочной соли меди (II) гидразином. Термическое разложение оксида меди(II) также дает оксид меди(I), так как последний обладает большей термической стабильностью. Тот же метод можно использовать для получения соединения из нитрата, карбоната и гидроксида меди (II).
Оксид меди(II) встречается в природе в виде тенорита. Это черное кристаллическое твердое вещество может быть получено пиролизом нитратных, гидроксидных или карбонатных солей. Он также образуется при нагревании порошкообразной меди на воздухе или в кислороде. В таблице ниже приведены некоторые характеристики оксидов меди.
Он также образуется при нагревании порошкообразной меди на воздухе или в кислороде. В таблице ниже приведены некоторые характеристики оксидов меди.
| Формула | цвет | Степень окисления | МП |
|---|---|---|---|
| CuO | черный | Медь 2+ | 1026разложить |
| Медь 2 О | красный | Медь + | 1230 |
Окислительно-восстановительная химия меди
Cu 2+ + e- → Cu + E=0,15 В
Cu + + e- → Cu E=0,52 В
Cu 2+ + 2e- → Cu E=0,34 В
При рассмотрении этих данных будет видно, что любой окислитель, достаточно сильный для превращения Cu в Cu + , более чем достаточно силен для превращения Cu + в Cu 2+ (0,52 по сравнению с 0,14 В). Поэтому не ожидается, что какие-либо стабильные соли Cu + будут существовать в водном растворе.
Поэтому не ожидается, что какие-либо стабильные соли Cu + будут существовать в водном растворе.
Также может произойти диспропорционирование:
2Cu + → Cu 2+ + Cu E=0,37 В или K=10 6
Координационные комплексы
Реакция ЭДТА 4- с медью(II) дала комплекс, в котором ЭДТА оказался пентадентатным, а НЕ гексадентатным, в отличие от других ионов M(II).
Cu(ЭДТА) 2-
Структура иона [Cu(ox) 2 ] 2- может быть описана как плоскоквадратная или как искаженный октаэдр, если рассматривать упаковку в кристаллической решетке. . В случае соли натрия отдельные единицы параллельны в ячейке с медью, связанной с атомами кислорода, координированными с медью в единицах, расположенных как вверху, так и внизу, тогда как в соли калия единицы не параллельны и если смотреть в трех единицах центральная находится почти под прямым углом к двум другим. Здесь медь связана с одним из некоординированных атомов кислорода в единицах выше и ниже ее.
Здесь медь связана с одним из некоординированных атомов кислорода в единицах выше и ниже ее.
Na+ и K+ соли [Cu(ox) 2 ] 2-
Cu(OH) 2 реагирует с NH 3 с образованием раствора, растворяющего целлюлозу. Это используется в промышленной подготовке района. Растворы содержат тетраммины и пентамины. С пиридином образуются только тетрамины, например, Cu(py) 4 SO 4 .
Взаимодействие меди(II) с аминокислотами широко изучено. Почти во всех случаях продукт содержит группы в -транс-, которая, как ожидается, будет более стабильной. В случае глицина первым осаждаемым продуктом всегда является цис- изомер, который при нагревании превращается в транс-. Для получения более подробной информации см. лабораторное руководство для C31L.
Аналитическое определение меди(II)
Полезным реагентом для аналитического определения иона меди(II) является натриевая соль N,N-диэтилдитиокарбамата. В разбавленных спиртовых растворах наличие следовых количеств Cu 2+ обозначается желтым цветом, который можно измерить спектрофотометром, а концентрацию определяют по графику закона Бера. Комплекс представляет собой Cu(Et 2 dtc) 2 , который можно выделить в виде коричневого твердого вещества.
В разбавленных спиртовых растворах наличие следовых количеств Cu 2+ обозначается желтым цветом, который можно измерить спектрофотометром, а концентрацию определяют по графику закона Бера. Комплекс представляет собой Cu(Et 2 dtc) 2 , который можно выделить в виде коричневого твердого вещества.
Cu(Et 2 dtc) 2
Ссылки
- Комплексы и переходные элементы первого ряда», D. Nicholls
- «Основы неорганической химии», Ф.А. Коттон, Г. Уилкинсон и П.Л. Гаус
- «Продвинутая неорганическая химия», Ф. А. Коттон, Г. Уилкинсон, К. А. Мурильо и М. Бохманн
- «Химия элементов», Гринвуд и Эрншоу
Авторы и авторство
Эта страница под названием 21.12A: Copper Metal распространяется по незаявленной лицензии, ее автором, ремиксом и/или куратором является Роберт Дж. Ланкашир.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Роберт Ланкашир
- Показать страницу TOC
- № на стр.

- Теги
- медь
Медь, пояснение – Global X ETF
На протяжении более 10 000 лет медь вносила значительный вклад в мировое социальное и технологическое развитие. Его особые свойства делают металл полезным для широкого спектра применений, включая строительство, промышленное оборудование, транспорт, производство электроэнергии и электронику. В этой статье мы попытаемся пролить свет на медь, ответив на шесть ключевых вопросов:
- Как производится медь?
- Где производится?
- Как выглядит производственно-сбытовая цепочка меди?
- Как используется медь?
- Какова динамика спроса и предложения?
- Как инвестировать в медь?
Как производится медь?
Медь встречается на поверхности Земли в основном в виде медных минералов или в смешанных рудах с другими металлами, такими как цинк и свинец. В основном его добывают открытым или подземным способом. Добыча открытым способом, на долю которой приходится около 90% производства меди, добывает руды вблизи поверхности земли по градуированным ступеням, ведущим в земную кору. 1,2
В основном его добывают открытым или подземным способом. Добыча открытым способом, на долю которой приходится около 90% производства меди, добывает руды вблизи поверхности земли по градуированным ступеням, ведущим в земную кору. 1,2
Когда руда слишком глубока для добычи открытым способом, можно использовать подземную добычу, которая включает рытье шахт в поверхности земли, чтобы позволить машинам или взрывчатым веществам отделить руду.
После извлечения руды ее необходимо обработать для достижения высокого уровня чистоты. Сульфидные руды проходят пятиэтапный процесс: 1) руда измельчается в мелкий песок для разрыхления медных минералов; 2) это пенопласт, когда песок смешивается с водой и химикатами, чтобы сделать частицы меди водоотталкивающими; 3) через смесь пропускается воздух, что позволяет минералам меди прикрепляться к пузырькам и всплывать на поверхность; 4) богатая медью пена затем сгущается в концентрат, который можно переплавить в более чистый медный концентрат, называемый анодными плитами; и 5) эти пластины далее перерабатываются посредством электролиза в пластины с медным катодом, которые 9Медь чистотой 9,99%. Руды оксида меди проходят трехстадийный процесс для достижения высокого уровня концентрации. Во-первых, в процессе, называемом кучным выщелачиванием, серная кислота используется для отделения меди от руды. Затем на стадии экстракции растворителем медь перемещается из выщелачивания в растворитель, удаляя примеси. Наконец, электролиз включает пропускание электрического тока через растворитель для положительного заряда ионов меди, что позволяет им наноситься на катод. 3
Руды оксида меди проходят трехстадийный процесс для достижения высокого уровня концентрации. Во-первых, в процессе, называемом кучным выщелачиванием, серная кислота используется для отделения меди от руды. Затем на стадии экстракции растворителем медь перемещается из выщелачивания в растворитель, удаляя примеси. Наконец, электролиз включает пропускание электрического тока через растворитель для положительного заряда ионов меди, что позволяет им наноситься на катод. 3
Где производится?
Чили — крупнейший в мире производитель меди, на долю которого приходится 27 % мирового производства.
По производству рафинированной меди, которая включает как медные аноды, так и металлолом, Китай является лидером, на его долю приходится 36% от общего объема переработки в мире.
Как выглядит производственно-сбытовая цепочка меди?
На приведенной ниже диаграмме показана цепочка создания стоимости меди, включая роль каждого из этих участников.
Как используется медь?
Медь и ее сплавы имеют широкий спектр применения, учитывая свойства металла как хорошего проводника электричества и тепла, а также устойчивость к коррозии. Вот некоторые из ее применений:
Оборудование: Медь широко используется в производстве оборудования, такого как провода, соединители и переключатели в электронном оборудовании, в качестве теплообменников в охлаждающем оборудовании, таком как кондиционеры и холодильники, а также в микропроцессорах мобильные телефоны, компьютеры и другие бытовые приборы.
Инфраструктура: Учитывая, что медь намного дешевле драгоценных металлов с аналогичной электропроводностью, ее часто выбирают для производства, передачи и распределения электроэнергии. Он также является ключевым компонентом систем возобновляемой энергии и передачи данных в телекоммуникационной отрасли, включая интернет-услуги и кабельную проводку. (Нажмите на эту ссылку, чтобы узнать, почему медь играет важную роль в инфраструктуре. )
)
Строительство: 9Медь 0175 часто используется для электропроводки жилых и коммерческих зданий. Учитывая его устойчивость к коррозии, он также часто применяется в кровельных, водопроводных и спринклерных системах. Поскольку медь и ее сплавы обладают противомикробными свойствами, латунные (изготавливаемые из меди и цинка) дверные ручки широко используются в общественных местах.
Транспорт: Медь используется в большинстве видов транспорта, таких как самолеты, поезда, грузовики и автомобили. В среднем автомобиль использует около 22,5 кг меди в виде двигателей, проводов, тормозов, подшипников, разъемов и радиаторов. 4 В более современных устройствах, таких как бортовые компьютеры, спутниковые навигационные системы и устройства безопасности, также используется медь. Медный никель используется в лодках и кораблях из-за его коррозионной стойкости и противообрастающих свойств. Электрические и гибридные транспортные средства, самолеты и высокоскоростные поезда следующего поколения еще больше полагаются на медь, чем более ранние версии, учитывая их более сильную зависимость от электроники.
Промышленность: Медь необходима для высокоэффективных двигателей, трансформаторов и генераторов. Он также используется для изготовления шестерен, подшипников и лопаток турбин. Его можно найти в теплообменных материалах, сосудах под давлением и чанах. Гребные винты, нефтяные платформы и береговые электростанции, подверженные воздействию морской среды, также сильно зависят от меди. 5,6,7
На Азию приходится 69% мирового потребления меди, за ней следуют Европа (18%) и Северная Америка (10%). Только на Китай приходится 50% мирового спроса на медь, что обусловлено крупными инвестициями страны в инфраструктуру. 8
Какова динамика спроса и предложения?
Спрос на медь тесно связан с глобальной экономической активностью. Поскольку на Азию приходится 69% мирового потребления меди, спрос со стороны стран с развивающейся экономикой, таких как Китай и Индия, значительно влияет на общий спрос на металл. Еще одним важным драйвером меди является жилищная промышленность США.
Еще одним важным драйвером меди является жилищная промышленность США.
Новые источники спроса появляются в результате таких мощных тем, как возобновляемые источники энергии, электромобили и развитие инфраструктуры. Например, для выработки солнечной энергии требуется около 5 кг меди на киловатт вырабатываемой энергии, что примерно вдвое больше, чем для производства обычной энергии. Для электромобиля требуется около 89 кг меди, что почти в четыре раза больше, чем для автомобиля с двигателем внутреннего сгорания. 9,10
Несмотря на обильные запасы, иногда возникают перебои в связи с забастовками и стихийными бедствиями в крупных производственных регионах, таких как Южная Америка. Возможность использования заменителей меди, ставшая возможной благодаря развитию технологий, может негативно сказаться на спросе на этот металл. Например, алюминий все чаще используется вместо меди в силовых кабелях, электрооборудовании и холодильниках, а сталь и титан могут использоваться в качестве теплообменников. 11
11
Международная исследовательская группа по меди (ICSG) прогнозирует, что мировое производство рафинированной меди вырастет на скромные 2,5% в 2018 году. Закрытие крупных плавильных заводов и сокращение производства на заводах в Чили, Японии и США привели к снижению уровня производства в 2017 году. Тем не менее, в 2018 году ожидается рост производства, поскольку производство на этих объектах возобновится, а Китай нарастит свои мощности.
Ожидается, что спрос на медь вырастет на 2% в 2018 г., главным образом за счет развития инфраструктуры в крупных странах, таких как Индия, Китай и США. Синхронизированный глобальный экономический рост в 2018 году также должен поддержать спрос. В целом ожидается, что в 2018 году спрос немного превысит предложение9.0042 12
Как инвестировать в медь?
Как и в случае со многими товарами, существует множество инвестиционных подходов к получению доступа к металлу, каждый из которых имеет свои собственные потенциальные преимущества и компромиссы. Вот несколько распространенных подходов:
Вот несколько распространенных подходов:
- Физическая медь: Инвестор может купить медные слитки непосредственно у торговца металлами. Однако складирование большого количества меди может привести к значительным затратам на хранение и страхование.
- Медные компании: Инвестиции в обыкновенные акции компаний, занимающихся добычей, разведкой или переработкой меди, могут косвенно влиять на изменение цен на медь. Доходность может быть обусловлена и другими факторами, такими как динамика цен на побочные продукты добычи меди, специфические деловые риски и геополитическая напряженность, которые могут снизить доходность.
- Фьючерсы на медь: Фьючерсы позволяют инвесторам делать ставки на цену меди на определенную дату. Однако, как и другие товарные фьючерсы, фьючерсы на медь сопряжены с риском контанго, когда будущие цены, как правило, превышают текущие спотовые цены, что со временем может привести к упадку инвестиций.


 Процесс гальванического меднения в большинстве случаев является…
Процесс гальванического меднения в большинстве случаев является… п…
п…  Ланкашир
Ланкашир Сера, железо и другие нежелательные элементы удаляются, и продукт называется черновой медью.
Сера, железо и другие нежелательные элементы удаляются, и продукт называется черновой медью. Обычными реагентами являются слабые кислоты, т.е. Н 2 SO 4 , H 2 SO 4 + Fe 2 (SO 4 ) 3 , кислые растворы хлоридов, например FeCl 2 , композиции хлорида аммония и соли аммония.
Обычными реагентами являются слабые кислоты, т.е. Н 2 SO 4 , H 2 SO 4 + Fe 2 (SO 4 ) 3 , кислые растворы хлоридов, например FeCl 2 , композиции хлорида аммония и соли аммония. Типичными электролитами являются кислые растворы, такие как серная кислота, H 2 СО 4 . Таким образом, ионы меди, которые присутствовали в органическом экстрагенте, растворяются в растворе электролита, образуя медьсодержащий «богатый электролит». Здесь снова происходит фазовое разделение. Вторая органическая фаза представляет собой обедненный органический экстрагент, тогда как вторая водная фаза представляет собой «богатый электролит». Бесплодный органический экстрагент затем рециркулируют для повторного использования при применении к выщелачивающему продукту.
Типичными электролитами являются кислые растворы, такие как серная кислота, H 2 СО 4 . Таким образом, ионы меди, которые присутствовали в органическом экстрагенте, растворяются в растворе электролита, образуя медьсодержащий «богатый электролит». Здесь снова происходит фазовое разделение. Вторая органическая фаза представляет собой обедненный органический экстрагент, тогда как вторая водная фаза представляет собой «богатый электролит». Бесплодный органический экстрагент затем рециркулируют для повторного использования при применении к выщелачивающему продукту.

