Ион h3s: Распродажа Xiaomi SOOCAS H3S Anion Волосы Сушилка Отрицательный ионный 360-градусный вращающийся красный Quick D
Содержание
Противоположно заряженный ион — Большая Энциклопедия Нефти и Газа, статья, страница 2
Cтраница 2
Однако противоположно заряженные ионы, образующие молекулу электролита, адсорбируются в эквивалентных количествах далеко не всегда.
[16]
Эти противоположно заряженные ионы могут соединяться вследствие существующего между ними электростатического притяжения. Однако этот процесс идет лишь при достаточной концентрации раствора. Образующийся продукт называют солью.
[17]
| Ионное произведение некоторых жидких веществ при 20 С.
[18] |
Образование противоположно заряженных ионов из нейтральных молекул ( ионизация, самоионизация, автопротолиз) — явление, свойственное электролитам.
[19]
Часть противоположно заряженных ионов калия удержится в адсорбционном слое, будучи притянута электростатическими силами к ядру ( их называют связанными про-тивоионами), остальные х свободных противоионов диф-фузно располагаются на некотором расстоянии от ядра.
[20]
| Схема строения кристаллической решетки графита.
[21] |
Между противоположно заряженными ионами в решетке действуют электростатические силы притяжения. В объеме кристалла каждый ион натрия окружен шестью ионами хлора и, наоборот, каждый ион хлора — шестью ионами натрия. По этой причине силы притяжения преобладают над силами отталкивания, чем и объясняется значительная прочность ионных решеток. О прочности их свидетельствуют высокие температуры плавления и малая летучесть ионных соединений.
[22]
Так как противоположно заряженные ионы, находясь в непрерывном движении, притягиваются друг к другу, в растворе возникают молекулы электролита; этот обратный процесс образования молекул из ионов называется мол яр из а ц и ей. Различные ионы могут иметь и различный по величине заряд. Ионы натрия и калия несут одинарный положительный заряд, ионы м агния, кальция, меди — двойной положительный заряд, ионы алюминия — тройной положительный заряд.
[23]
Так как противоположно заряженные ионы притягиваются друг к другу по закону Кулона до тех расстояний, которые допускают их диаметры2, то прочность связи должна расти с увеличением числа элементарных зарядов ( валентности) иона и с уменьшением его размера. Действительно, в ряде Н2О, h3S, h3Se и Н2Те ион Н тем легче отщепляется, чем больше радиус аниона: Н2О — очень слабая, h3S — слабая, Нг5е — умеренная и Н2Те — довольно сильная кислота. В ряде НС1, h4S, Н3Р, h5Si способность отщеплять Н падает с ростом заряда аниона: НС1 — сильная, h5S — слабая кислота, а РН3 и Sih5 не обнаруживают кислых свойств.
[24]
Плотно упакованные противоположно заряженные ионы кристаллической решетки могут взаимно поляризоваться. Вследствие электростатического взаимодействия катионы деформируют электронные оболочки анионов, и наоборот.
[25]
Эквивалентное количество противоположно заряженных ионов ( противоионов), находящихся в растворе, удерживается у заряженной поверхности в силу электрического притяжения.
[26]
Эквивалентное количество противоположно заряженных ионов ( противоионов), находящихся в растворе, удерживается у заряженной поверхности в силу электрического притяжения. Противоионы и адсорбированные ионы решетки образуют электрический двойной слой. Противоионы не могут приблизиться к поверхности меньше, чем на определенное предельное расстояние ( внутренняя плоскость Гельмгольца [90]), которое зависит от радиуса ионов.
[27]
При рекомбинации противоположно заряженных ионов могут происходить процессы, существенно влияющие на кинетику радиа-ционно-химических реакций и их энергетический выход. В главе II было показано, что эти процессы могут приводить к образованию атомов и радикалов, а также конечных продуктов реакции. Такой случай, видимо, имеет место в рассмотренной выше реакции радиационного образования озона.
[28]
При рекомбинации противоположно заряженных ионов могут происходить процессы, существенно влияющие на кинетику радиационно-химических реакций и их энергетический выход. В главе II было показано, что эти процессы могут приводить к образованию атомов и радикалов, а также непосредственно конечных продуктов реакции. Такой случай, видимо, имеет место в рассмотренной выше реакции радиационного образования озона.
В главе II было показано, что эти процессы могут приводить к образованию атомов и радикалов, а также непосредственно конечных продуктов реакции. Такой случай, видимо, имеет место в рассмотренной выше реакции радиационного образования озона.
[29]
Рекомбинация пары противоположно заряженных ионов имеет более высокую вероятность, чем рекомбинация положительного иона с электроном. Объясняется это тем, что при данной температуре газа ионы движутся менее быстро, чем электроны, и поэтому более длительное время находятся вблизи друг от друга.
[30]
Страницы:
1
2
3
4
5
Теория электролитической диссоциации. Протолитическая теория кислот и оснований презентация, доклад
Теория электролитической диссоциации. Протолитическая теория кислот и оснований.
Электролиты.
Неэлектролиты
По способности проводить электрический ток в водном растворе или в расплаве все вещества можно разделить на электролиты и неэлектролиты.
Электролитами называют вещества, водные растворы или расплавы которых проводят электрический ток.
Электролиты.
Неэлектролиты
К электролитам относятся соли, кислоты ищелочи. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи.
Неэлектролитами называют вещества, водные растворы или расплавы которых не проводят электрический ток.
К неэлектролитам относятся, например, кислород, водород, многие органические вещества.
В молекулах этих веществ существуют ковалентные неполярные или малополярные связи.
Электролиты.
Неэлектролиты
В 1887г. Шведский учёный
С. Аррениус для объяснения
Аррениус для объяснения
особенностей водных растворов
веществ предложил теорию
электролитической диссоциации.
В дальнейшем эта теория была
развита многими учёными, в том
числе И.А. Каблуковым и
В.А. Кистяковским.
Сванте Аррениус
С.Аррениус-основоположник теории электролитической диссоциации
Основные положения электролитической диссоциации
1.Молекулы электролитов при растворении в воде или расплавлении распадаются на ионы.
Процесс распада молекул электролитов на ионы в водном растворе или в расплаве называется электролитической диссоциацией или ионизацией.
Основные положения электролитической диссоциации
Ионы — это атомы или группы атомов, имеющие положительный или отрицательный заряд.
Ионы могут быть
простые (Na+, Mg2+ , S2-, Cl- ):
сложные (SO32-, Nh5+, SO42-, PO43-).
Основные положения электролитической диссоциации
2. В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы движутся к положительно заряженному электроду (аноду).
Основные положения электролитической диссоциации
Положительные ионы называются катионами, отрицательные ионы-анионами.
К катионам относятся ион водорода Н+, ион аммония Nh5+, ионы металлов Na+, K+, Fe2+,Fe3+, Al3+, катионы основных солей CuOH+, A1(OH)2+, FeOh3+
К анионам относятся гидроксид-ион ОН-, ионы кислотных остатков I-, Вr-, Сl-, NO3-, SO32-, Сr2О7 ;
кислых солей НСО3-, Н2РО4-, Н2РО4-
Диссоциация многих электролитов —процесс обратимый.
Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (ионизация или диссоциация) и соединение ионов в молекулы (ассоциация или моляризация).
Основные положения электролитической диссоциации
Основные положения электролитической диссоциации
Уравнение диссоциации азотистой кислоты HNO2 записывается таким образом:
ионизация (диссоциация)
НNO2 H+ + NO2-
моляризация (ассоциация)
Общая сумма зарядов катионов равна общей сумме зарядов анионов, так как растворы и расплавы нейтральны.
Гидратация ионов
Электролитическая диссоциация в растворе происходит за счет сложного физико-химического взаимодействия молекул растворителя с электролитом.
Гидратация ионов
Согласно химической теории растворов Д. И. Менделеева, при растворении веществ в воде происходит химическое взаимодействие растворенного вещества с молекулами воды.
И. Менделеева, при растворении веществ в воде происходит химическое взаимодействие растворенного вещества с молекулами воды.
Гидратация ионов
В результате взаимодействия растворенного вещества с молекулами воды образуются химические соединения -гидраты.
И.А. Каблуков развил это положение
Д.И. Менделеева, впервые высказав мысль о возможной гидратации не только молекул, но и ионов, которые особенно склонны к гидратации.
Соединяясь с молекулами воды, ионы становятся гидратированными и более устойчивыми.
Механизм электролитической диссоциации.
I. Диссоциация электролитов с ионной связью.
При растворении в воде ионных соединений, например, хлорида натрия, его ионы, находящиеся в узлах кристаллической решетки, взаимодействуют с диполями воды. При этом положительные полюсы молекул воды
притягиваются к отрицательным хлорид-ионам С1-, отрицательные полюсы — к положительным ионам натрия Na+.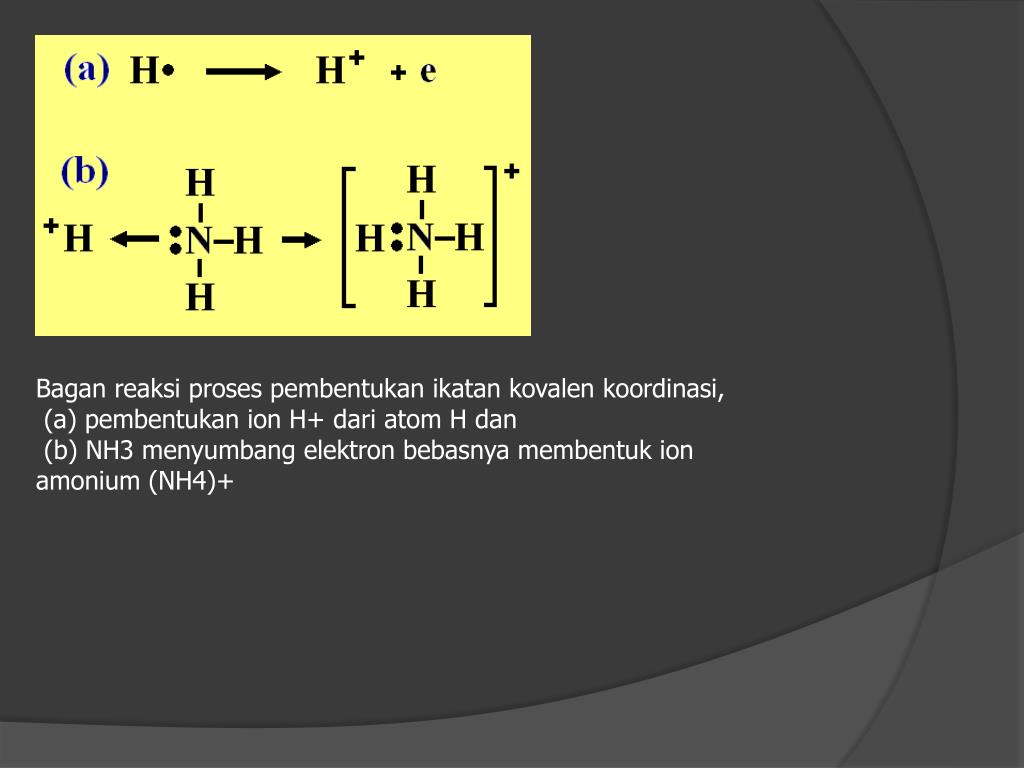
Между ионами электролита и диполями воды возникают силы взаимного притяжения, которые оказываются прочнее межионных связей в кристалле. В результате связь между ионами в кристалле ослабляется, кристаллическая решетка ионного соединения разрушается, и ионы в
гидратированном виде переходят в раствор NaCl Na+ + Cl-
Механизм электролитической диссоциации.
При растворении в воде веществ НС1 происходит ориентация диполей воды и возникают междипольные связи.
В результате такого диполь-дипольного взаимодействия изменяется характер химической связи в молекуле НС1.
Механизм электролитической диссоциации
Диссоциации электролитов с полярной ковалентной связью.
Связь в молекуле электролита становится более полярной, а затем превращается в ионную.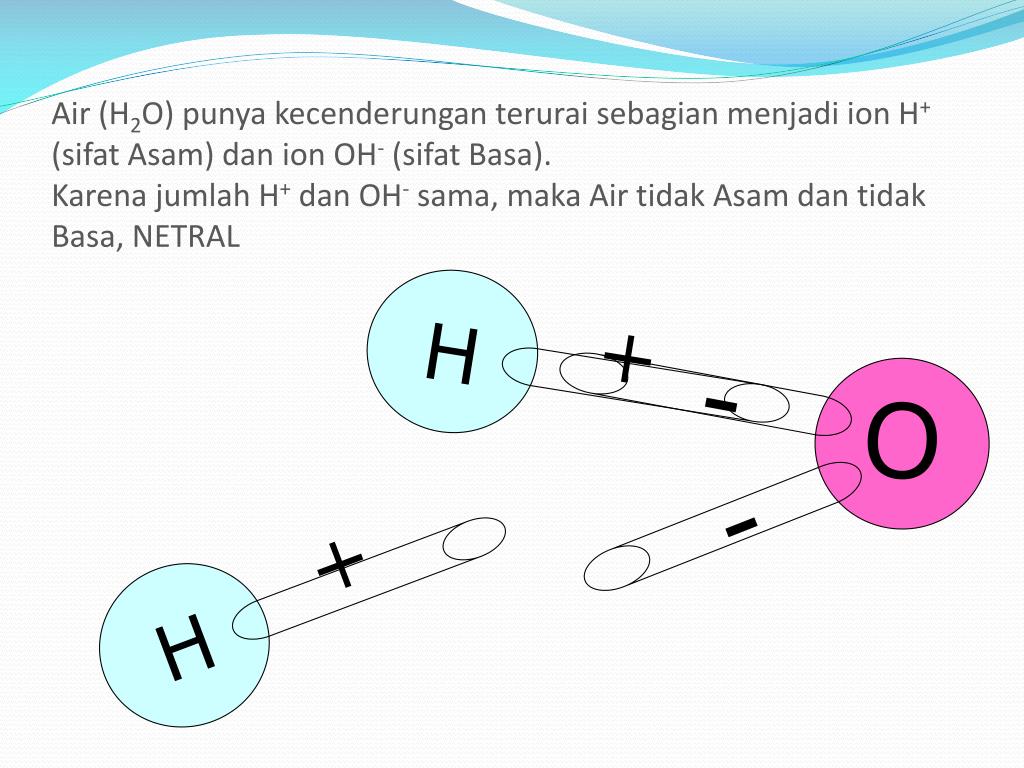 Эта связь легко разрывается с образованием гидратированных ионов, которые переходят в раствор.
Эта связь легко разрывается с образованием гидратированных ионов, которые переходят в раствор.
Главной причиной диссоциации молекул электролитов на ионы в водных растворах является гидратация ионов.
Механизм электролитической диссоциации
Степень диссоциации
(ионизации)
В водных растворах некоторые электролиты полностью распадаются на ионы.
Другие электролиты распадаются на ионы частично. Большая часть их молекул остается в растворе в недиссоциированном виде.
В растворах таких электролитов одновременно присутствуют ионы и недиссоциированные молекулы растворенного вещества.
Степень диссоциации
(ионизации)
Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита используют понятие
«степень электролитической диссоциации».
Степень диссоциации обозначают буквой «α» и часто выражают в процентах, реже в долях единицы.
Степень диссоциации
(ионизации)
Степень электролитической диссоциации равна отношению числа молекул, которые распались на ионы, к общему числу растворенных молекул электролита:
где n — число молекул, распавшихся на ионы;
N — общее число растворенных молекул.
Сильные электролиты — это такие электролиты, для которых степень диссоциации в водных растворах равна 1 (100%).
К сильным электролитам относятся:
1. Практически все соли;
2. Кислоты — НС1О4, НС1О3, HNO3, h3SO4, HMnO4, h3Cr2О7, HI, HBr, НС1, h3CrО4;
3. Щелочи- LiOH, NaOH, KOH, CsOH, RbOH, Ca(OH)2 ,Sr(OH)2, Ba(OH)2.
Сильные и слабые электролиты
Слабые электролиты — это такие электролиты, для которых степень диссоциации в водных растворах меньше
1 (100%).
Сильные и слабые электролиты
К слабым электролитам относятся:
1. Слабые кислоты — НС1О2, НС1О, HNO2, h3CO3, h3SiО3, h4PO4, HF, h4BO3; Ch4COOH, h4S, HCN
Слабые кислоты — НС1О2, НС1О, HNO2, h3CO3, h3SiО3, h4PO4, HF, h4BO3; Ch4COOH, h4S, HCN
2. Слабые малорастворимые в воде основания и амфотерные гидроксиды: Fe(OH)2 Fe(OH)3 Cu(OH)2 Pb(OH)2, A1(OH)3, Cr(OH)3;
3. Вода Н2О.
4. Nh5 OH.
Сильные и слабые электролиты
Степень ионизации электролита зависит от его концентрации в растворе. Разбавление раствора ведет к повышению степени диссоциации электролита, потому что с уменьшением его концентрации уменьшается вероятность встречи ионов в растворе.
Повышение концентрации электролита в растворе понижает степень его ионизации.
Факторы, влияющие на диссоциацию
Степень ионизации зависит и от изменения температуры раствора электролита.
При повышении температуры степень диссоциации электролита увеличивается.
Факторы, влияющие на диссоциацию
На степень диссоциации влияет добавление одноименных ионов к раствору слабого электролита.
Например, если к раствору уксусной кислоты СН3СООН прилить раствор ацетата натрия Ch4COONa, то равновесие обратимого процесса диссоциации уксусной кислоты
СН3СООН СН3СОО- + Н+ согласно принципу Ле-Шателье смещается влево. Поэтому степень диссоциации уксусной кислоты уменьшается.
Факторы, влияющие на диссоциацию
Константа диссоциации (ионизации)
Для количественной характеристики слабых электролитов применяют константу диссоциации (К). Любая обратимая реакция характеризуется константой равновесия.
В случае диссоциации константу равновесия называют константой диссоциации (Кд) или константой ионизации.
Для слабого электролита общей формулы: AnBm
AnBm пАm+ + mBn-
согласно закону действия масс, в состоянии равновесия, константа диссоциации равна:
Кд=[Аm+]n ∙ [Bn-]m
[AnBm]
Константа диссоциации (ионизации)
Величина константы ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в его растворе, тем сильнее электролит. Например:
Чем больше константа диссоциации, тем больше ионов в его растворе, тем сильнее электролит. Например:
Кд(СН3СООН)=[СН3СОО-] ∙ [Н+] = 2∙10-5;
[СН3СООН]
Кд(HCN)= [Н+] ∙ [CN-] = 7∙10-10 при25°С.
[HCN]
Константа диссоциации (ионизации)
Диссоциация кислот
Кислоты — это электролиты, которые при диссоциации образуют только один вид катионов — катионы водорода Н+.
Например: h3SO4 = 2Н++ SO42-
Слабые многоосновные кислоты
(h3SO3, Н2СО3, h3S, Н3РО4) диссоциируют ступенчато и характеризуются несколькими константами диссоциации.
Число ступеней диссоциации равно основности слабой кислоты.
На первой ступени диссоциации сероводородной кислоты:
h3S Н+ + HS-,
К΄д=[Н+] ∙ [HS-] = 6,0 ∙10-8
[h3S]
Диссоциация кислот
На второй ступени диссоциации от сложного гидросульфид-иона HS- отщепляется катион водорода Н+по уравнению:
HS- Н+ + S2-,
К΄΄д(HS-)= [Н+] ∙ [S2-] = 1,0 ∙10-14.
[HS-]
Диссоциация кислот
Диссоциация кислот
К΄΄д(HS-)=[Н+] ∙ [S2-] = 1,0 ∙10-14
[HS-]
Сравнение величин К΄д и К˝д показывает, что диссоциация по второй ступени протекает в значительно меньшей степени, чем по первой.
Диссоциация оснований
Основания — это электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы ОН-.
Например:
NaOH = Na++ OH-
Слабые многокислотные основания диссоциируют ступенчато и характеризуются несколькими константами диссоциации.
Число ступеней диссоциации равно кислотности слабого основания.
Рb(ОН)2 РbОН++ОН-
д=[РbОН+] ∙ [ОН-] =9,6 ∙10-4(tо=25оС )
[Рb(ОН)2 ]
Диссоциация оснований
На второй ступени диссоциации происходит отщепление гидроксид-иона от сложного катиона РbОН+
Рb(ОН)2 РbОН2++ОН-
Диссоциация оснований
Амфотерные гидроксиды могут реагировать и с кислотами, и с основаниями, то есть имеют двойственные свойства.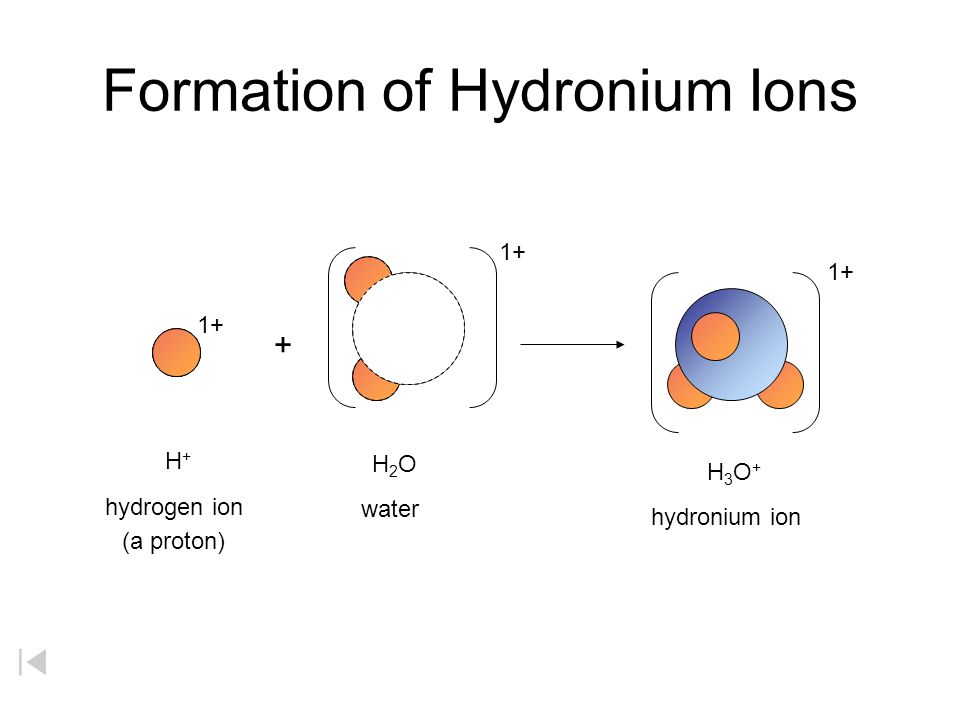
Двойственный характер амфотерных гидроксидов объясняет теория электролитической диссоциации.
Диссоциация амфотерных гидроксидов
Амфотерные гидроксиды — это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н+ и гидроксид-анионы ОН-, т. е. диссоциируют по типу кислоты и по типу основания.
2Н++ZnO22- h3ZnO2 Zn(OH)2 Zn2++2ОН —
диссоциация в растворе диссоциация
по типу кислоты Zn(OH)2 по типу основания
(осадок)
Диссоциация амфотерных гидроксидов
Диссоциация солей
Нормальные соли — сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
Например:
Al2(SO4)3 2А13+ + 3SО42-
Диссоциация солей
Кислые соли — сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток.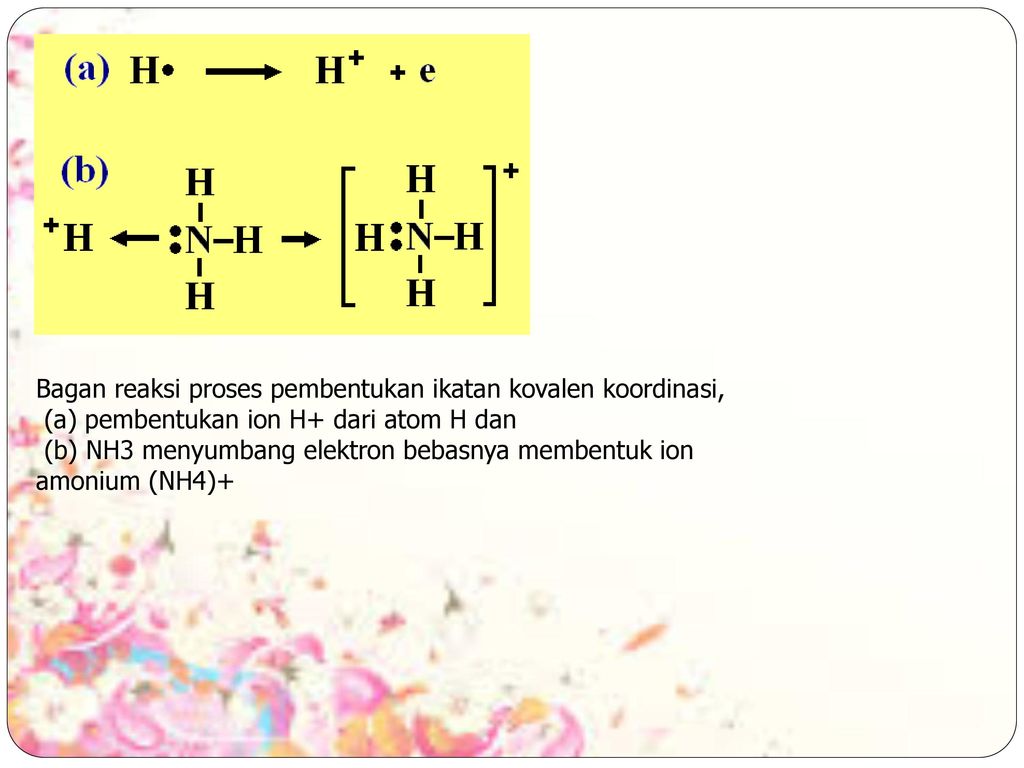
Например:
NaHCO3 Na+ + НСО3- (α = 1)
Гидрокарбонат-ион в незначительной степени диссоциирует по уравнению:
НСО3- Н+ + СО3- (α
Диссоциация солей
В водных растворах кислых солей содержатся следующие ионы:
катионы металла Меn+,
катионы водорода Н+,
сложные анионы,
содержащие атомы водорода и анионы кислотного остатка Ах-.
Диссоциация солей
Основные соли — электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы, состоящие из атомов металла и гидроксогрупп ОН-.
Fe(OH)2Cl Fe(OH)2+ + Cl- (α = 1)
Fe(OH)2+ FeOh3+ + ОH- (α Fe(OH)2+ Fe3+ + OH- (α
Основные соли, как и кислые соли, сначала диссоциируют как сильные электролиты. Незначительно диссоциируют сложные ионы.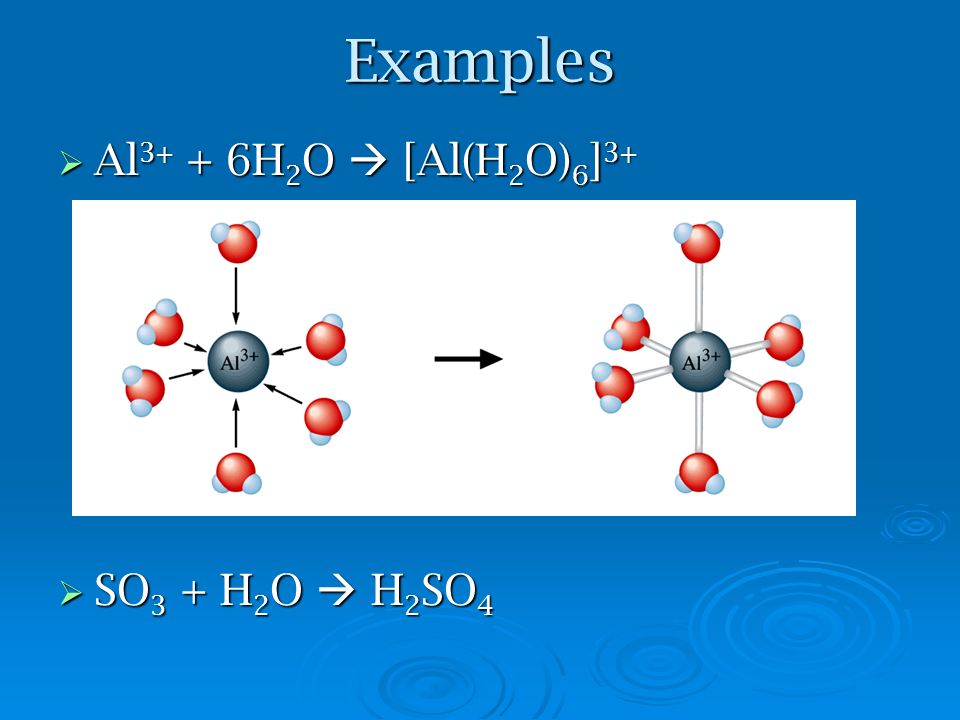
В водных растворах основных солей находятся ионы: катионы металла Меn+, сложные катимы, содержащие гидроксогруппы, анионы кислотного остатка Асх- и анионы гидроксогрупп ОН-.
Диссоциация солей
Диссоциация
воды. рН
Вода как слабый электролит в незначительной степени диссоциирует на ионы Н+ и ОН-, которые находятся в равновесии с недиссоциированными молекулами
Н2О -Н+ + ОН-.
Опытом установлено, что в 1 л воды при комнатной температуре (22°С) диссоциации подвергаются лишь 10-7 моль и при этом образуется 10-7 моль/л ионов Н+ и10-7 моль/л ионов ОН-.
Диссоциация
воды. рН
Произведение концентраций ионов водорода и гидроксид-ионов в воде называется ионным произведением воды (обозначается Кв).
При определенной температуре Кв — величина постоянная.
Численное значение его при температуре 22°С равно 10-14:
Кв = [Н+][ОН-] = 10-7 ∙ 10-7 = 10-14
Диссоциация
воды. рН
рН
Из постоянства произведения [Н+]и [ОН-] следует, что при увеличении концентрации одного из ионов воды соответственно уменьшается концентрация другого иона.
Это позволяет вычислять концентрацию
Н+-ионов, если известна концентрация гидроксид-ионов ОН-, и наоборот.
Если в водном растворе [Н+]= 10-3 моль/л, то [ОН-] определяется так:
Диссоциация
воды. рН
Концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН .
Водородным показателем рН называется отрицательный десятичный логарифм концентрации водородных ионов:
рН = -lg[H+]
где [Н+] концентрация ионов водорода, моль/л.
Диссоциация
воды. рН
С помощью рН реакция растворов характеризуется так: нейтральная рН =7, кислая рН 7.
Чем меньше рН, тем больше концентрация ионов Н+ т. е.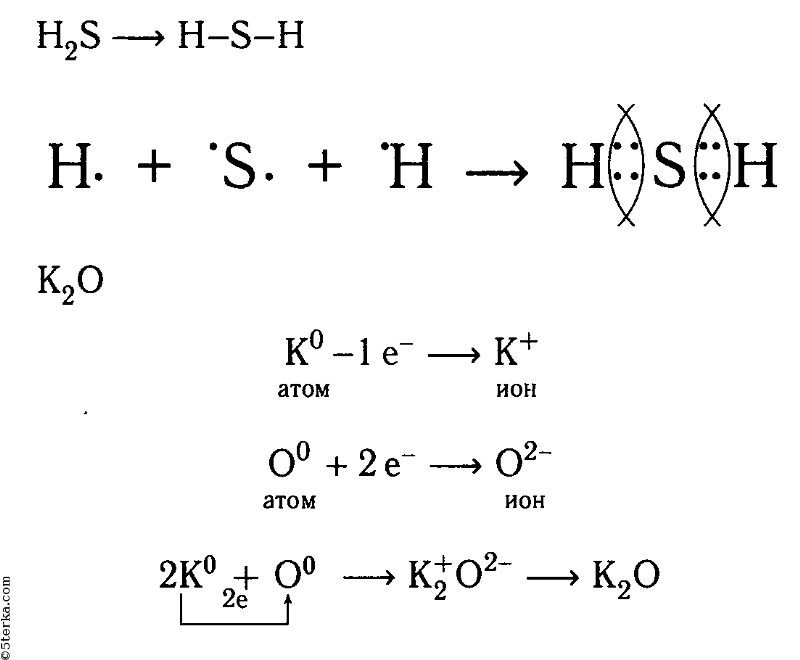 выше кислотность среды; и наоборот, чем больше рН, тем меньше концентрация ионов Н+, т. е. выше щелочность среды.
выше кислотность среды; и наоборот, чем больше рН, тем меньше концентрация ионов Н+, т. е. выше щелочность среды.
Диссоциация
воды. рН
Существуют различные методы измерения рН. Качественно реакцию среды и рН водных растворов определяют с помощью индикаторов.
Индикаторами называются вещества, которые обратимо изменяют свой цвет в зависимости от среды раствора, т. е. рН раствора.
На практике применяют индикаторы лакмус, метиловый оранжевый (метилоранж) и фенолфталеин.
Реакции обмена в водных растворах электролитов
Многие химические реакции протекают в водных растворах. Если в этих реакциях участвуют электролиты, то следует учитывать, что они находятся в водном растворе в диссоциированном состоянии, т. е. или только в виде ионов (сильные электролиты) и частично в виде молекул (слабые электролиты).
Реакции обмена в водных растворах электролитов
Реакции между водными растворами электролитов — это реакции, в которых участвуют ионы. Поэтому такие реакции называются ионными реакциями.
Поэтому такие реакции называются ионными реакциями.
Эти реакции возможны только в том случае, если между ионами происходит химическое
взаимодействие.
Реакции обмена в водных растворах электролитов
Ионы одного электролита связываются с ионами другого электролита с образованием:
а) нерастворимого вещества;
б) газообразного вещества;
в) малодиссоциирующего вещества
(слабый электролит).
г) комплексного соединения.
Ионные реакции и уравнения
При составлении ионных уравнений реакций следует руководствоваться тем, что вещества малодиссоциированные, малорастворимые (выпадающие в осадок) и газообразные изображаются в молекулярной форме.
Ионные реакции и уравнения
Сильные растворимые электролиты, как полностью диссоциированные, пишутся в виде ионов. Например:
Например:
AgNO3 + HCl = AgCl↓ + HNO3
Ag+ + NО3- + H+ + Cl- = AgCl↓ + H+ + NO3-
Ag++ Cl- = AgCl↓
Na2CO3+h3SO4=Na2SO4+CO2↑+h3O
2Na++CO32-+2H++SO42-=2Na++SO42-+CO2↑+h3O
CO32-+2H+= CO2↑+h3O
Фен
Xiaomi SOOCAS h4S с отрицательными ионами для быстрой сушки предлагается за $58,69
предложения
Хотя Xiaomi является технологическим брендом, он стал «продуктовым магазином» в развитии за многие годы. Ее продукция охватывает широкий спектр и отвечает потребностям многих различных аспектов жизни. Несколько месяцев назад в официальном микроблоге Xiaomi было объявлено, что она выиграла чемпионат Германии 2018 года. Быстросохнущий фен SOOCAS с отрицательными ионами, удостоенный награды iF design, был официально представлен в торговом центре Xiaomi Youpin Mall 9.0003
Купон 1 (60,61 долл. США): AFFBG10 на Banggood
Купить Xiaomi Soocas H4S Отрицательный ионный ионный сухой сухый для волос на Banggood для 60,61 Xiaomitoday Best 5%
Купон 1 ($ 90,22): All5%.
Купить быстросохнущий фен Xiaomi SOOCAS h4S с отрицательными ионами на Gearbest за $90,22 XiaomiToday Best Deals
SOOCAS — это корпоративный бренд эко-сети под управлением Xiaomi. Предыдущим основным бизнесом была электрическая зубная щетка SOOCAS Sonic, а теперь к ней добавился фен. Внешний вид, быстросохнущий фен SOOCAS с отрицательными ионами интегрирован в японскую эстетическую концепцию, простой, красное вино, слабое серебро с красным, интегрированный дизайн, бесшовный, без винтов, корпус из алюминиевого сплава, эффективно снижает ветер, температуру при котором используется картридж, чтобы избежать перегрева.
См. также: Мини-массажер для шеи Xiaomi С 5800 оборотов двигателя в минуту, 15 минут для расслабления мышц Цена 81,30 долл. США больший объем воздуха. Конический внешний диаметр воздушного потока постепенно увеличивается в направлении ветра и постепенно формируется конической жидкостью. Расхождение, значительно снижающее сопротивление. Кроме того, двухканальный быстросохнущий фен SOOCAS с отрицательными ионами выводит десятки миллионов отрицательных ионов высокой концентрации на показанный слой, чтобы поддерживать влажность и блеск, избегать статического электричества для волос. И в нем используется съемное вентиляционное отверстие, которое можно поворачивать на 360°, а длинная плоская форма концентрирует ветер, чтобы сдуть вашу любимую прическу.
Кроме того, двухканальный быстросохнущий фен SOOCAS с отрицательными ионами выводит десятки миллионов отрицательных ионов высокой концентрации на показанный слой, чтобы поддерживать влажность и блеск, избегать статического электричества для волос. И в нем используется съемное вентиляционное отверстие, которое можно поворачивать на 360°, а длинная плоская форма концентрирует ветер, чтобы сдуть вашу любимую прическу.
Мощность быстросохнущего фена SOOCAS с отрицательными ионами составляет 1800 Вт. Он мягче, чем профессиональный 2200 Вт, и быстрее и быстрее, чем обычный бытовой 1000 Вт. Эта сила чувствует себя как раз, не повреждает волосы, сдувает волосы и быстро сохнет. Насадка фена для быстрой сушки с отрицательными ионами SOOCAS, эта воздушная насадка также довольно особенная, в ней используется конструкция с двухслойной изоляцией, тепло не контактирует напрямую с внешним слоем фурмы. Это может эффективно избежать ожогов, вызванных перегревом, и является более безопасным.
Читайте также: Bluetooth-наушники Xiaomi Earphones Earbuds за $52,99
Размер и ощущение ручки очень хорошо продуманы, и она не кажется тяжелой. Материалы, похожие на кожу, не легко скользят. Все его тело очень маленькое, и девушки могут легко им пользоваться, не чувствуя усталости. Каждый раз, когда вы используете его, вы можете высвобождать миллионы отрицательных ионов для защиты ваших волос. Двойной канал фена Susie может выводить отрицательные ионы высокой плотности на поверхность волос, делая их увлажненными и сияющими.
Coupon 1 ($60.61): AFfbG10 on banggood
Buy The Xiaomi SOOCAS h4S Negative Ion Quick Dry Hair Dryer On Banggood For $60.61 XiaomiToday Best Deals
Coupon 1 ($90.22): ALL5%OFF on Gearbest
Купить быстросохнущий фен Xiaomi SOOCAS h4S с отрицательными ионами на Gearbest за $90,22 Лучшие предложения XiaomiToday
где купить, характеристики и отзывы
- Технические характеристики
- Buy
- Analysis
- Reviews (5)
- FAQs
Specifications
Dimensions
243 x 158 x 75
Weight
600 g
Power
1800 W
Foldable
No
Скорости/Режимы
3
Сообщить об ошибке
Купить Soocas h4S по лучшей цене
Cindy’s Small Electrical Store
(0 продано)
Посмотреть предложение
Анализ Soocas h4S0075
Сначала появились электрические зубные щетки всех возможных типов. Теперь последним, кто присоединится к вечеринке, является Soocas h4S, , новый фен с системой отрицательных ионов и роторным всасыванием мощностью 1800 Вт.
Теперь последним, кто присоединится к вечеринке, является Soocas h4S, , новый фен с системой отрицательных ионов и роторным всасыванием мощностью 1800 Вт.
Когда мы открываем упаковку, мы находим сумку для хранения, одну головку использования, инструкцию по эксплуатации и, конечно же, эффективный Soocas h4S. Он имеет размеры 15,80 х 7,50 х 24,30 и весит 600 граммов, что делает его одним из самых удобных с точки зрения использования фенов на рынке. 9№ 0003
Он изготовлен на основе алюминиевого сплава и АБС-пластика, что придает ему премиальный и минималистский вид благодаря привлекательному и элегантному белому цвету с красными акцентами. В его корпус встроена кнопка для выбора одного из трех режимов: диффузный, интенсивный и расчесанный. Чтобы определить, в каком режиме мы находимся, нам нужно будет только посмотреть на светодиоды.
Этот Soocas h4S представлен как отличный конкурент другим брендам благодаря соотношению цена/качество, что очень характерно для азиатского континента.
Отзывы посетителей
5 отзывов
Сушильная машина очень привлекательна и хорошо работает.
При использовании я понял, что это как и любой другой нормальный фен. Сохнет за то же время, издает тот же шум, я не заметила улучшения пушистости моих волос или, по крайней мере, того, что она уменьшила их, и именно поэтому я решила его купить. Подчеркну только, что он не нагревается; то есть вы используете его и храните, вы не ждете, пока он остынет, чтобы убрать его. Короче говоря, это обычная и актуальная сушилка с очень премиальной отделкой, европейской вилкой и футляром для хранения. По окончательной цене это была не очень удачная покупка. На самом деле, я бы не рекомендовал его, если только это не подарок.
Купил для своей девушки. Она склонна сильно сушить волосы. Она может сушить волосы так же быстро, как и устройства с высокой температурой, без напряжения и повреждения волос, которые возникают при использовании фена с высокой температурой.
